
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач
|
|
|
|
Определение молярного и удельного коэффициентов светопоглощения.
ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Содержание контрольной работы
2. Определение открываемого минимума фотометрических реакций.
3. Расчет концентрации и массы определяемого вещества при фотометрическом анализе.
4. Расчет концентрации и массы определяемого вещества при флуориметрическом анализе.
Пример 1.1. Оптическая плотность раствора KMnO4 c концентрацией 6,00 мкг/мл, измеренная в кювете с толщиной слоя 2.00 см, при 525 нм равна 0,154. Рассчитайте молярный и удельный коэффициенты поглощения KMnO4.
Решение: Определяем молярную концентрацию KMnO4, учитывая, что титр 6,00 мкг/мл = 6,00×10-6 г/мл:
С(KMnO4)= 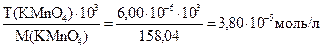
Рассчитываем молярный коэффициент поглощения KMnO4:
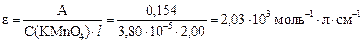
Рассчитываем удельный коэффициент поглощения KMnO4, учитывая, что 6,00 мкг/мл = 6,00×10-4 г/100 мл
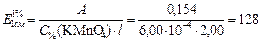
Ответ: 2,03×103 моль-1×л×см-1; 128.
Пример 1.2. Для раствора, содержащего 0,0300 г оксигемоглобина в 100 мл, при 575 нм в кювете толщиной 1,00 см пропускание составило 53,5 %. Вычислите удельный коэффициент поглощения.
Решение: Определяем оптическую плотность раствора;
А = – lg T = – lg 0,535 = 0,272.
Вычисляем удельный коэффициент поглощения:
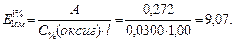
Ответ: 9,07
Пример 2.1. Рассчитайте определяемый минимум железа(III) в виде тиоцианатного комплекса при 480 нм. Значение молярного коэффициента поглощения равно 6300, толщина поглощающего слоя 5 см, конечный объем фотометрируемого раствора 25 мл. Наименьшее значение оптической плотности, измеряемое прибором, равно 0,005.
Решение:
m(FeIII) = Cмин (FeIII) ∙Vмин ∙ M(FeIII) = 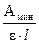 ∙Vмин ∙ M(FeIII) =
∙Vмин ∙ M(FeIII) = 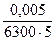 ∙25∙10–3∙55,85 = 2∙10–7 г = 0,2 мкг.
∙25∙10–3∙55,85 = 2∙10–7 г = 0,2 мкг.
Ответ: 0,2 мкг
Пример 2.2. Молярный коэффициент поглощения комплекса серебра с дитизоном в растворе при 462 нм равен 30500 л∙моль–1 ∙см–1. Какое минимальное содержание серебра (в %) можно определить в навеске 1 г, растворенной в 25 мл, если минимальное значение оптической плотности, которое с удовлетворительной точностью можно измерить на приборе, равно 0,002? Толщина поглощающего слоя кюветы 2 см.
Решение: Рассчитываем определяемый минимум ионов серебра
m(Ag+) = Cмин (Ag+) ∙Vмин ∙ M(Ag+) = 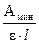 ∙Vмин ∙ M(Ag+) =
∙Vмин ∙ M(Ag+) = 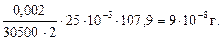
Определяем минимальное определяемое содержание серебра в пробе:
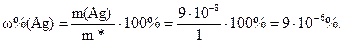
Ответ: 9∙10–6%
Пример 3.1. Вычислите молярную концентрацию и титр раствора рутина (витамина Р), если при 258 нм оптическая плотность анализируемого раствора равна 0,780, а стандартного раствора с концентрацией 6,0·10-5 моль/л – 0,640. М(рутина) = 610 г/моль.
Решение: Молярную концентрацию рутина определяем по формуле для метода одного стандарта:
С(рутина)= 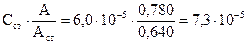 моль/л
моль/л
Определяем титр рутина:
Т(рутина)= 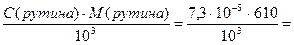 4,46∙10-5 г/мл = 44,6 мкг/мл
4,46∙10-5 г/мл = 44,6 мкг/мл
Ответ: 7,3×10-5 моль/л, 44,6 мкг/мл.
Пример 3.2. Вычислите молярную концентрацию и титр Cu(II) (в мкг/мл), если оптическая плотность раствора аммиаката меди в кювете с l = 2,00 см составляет 0,282, а молярный коэффициент поглощения 423.
Решение: Определяем молярную концентрацию Cu2+ по значению молярного коэффициента поглощения:
С(Cu2+) = 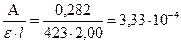 моль/л
моль/л
Определяем титр меди(II):
T(Cu2+) = 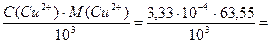 2,12×10-5 г/мл = 21,2 мкг/мл
2,12×10-5 г/мл = 21,2 мкг/мл
Ответ: 3,33×10-4 моль/л, 21,2 мкг/мл.
Пример 3.3. К 2,00 мл раствора витамина В12 добавили 18,00 мл воды и измерили оптическую плотность полученного раствора при длине волны 361 нм в кювете с толщиной поглощающего слоя 1,00 см; А = 0,405. Рассчитайте концентрацию витамина В12 в растворе (в мг/мл), если удельный коэффициент поглощения чистого витамина В12 при 361 нм равен 207.
Решение: Определяем С% витамина В12 в фотометрируемом растворе по значению удельного коэффициента поглощения:
С*% (В12) = А / (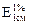 ∙ l) = 0,405/(207∙1,00) = 1,97∙10-3 г/100 мл.
∙ l) = 0,405/(207∙1,00) = 1,97∙10-3 г/100 мл.
Рассчитываем титр витамина В12 в фотометрируемом растворе
Т*(В12) = С*% (В12)/100 = 1,97∙10-3 /100 = 1,97∙10-5 г/мл =1,97∙10-2 мг/мл.
Рассчитываем титр витамина В12 в исходном растворе, учитывая, что объем фотометрируемого раствора равен 2,00 + 18,00 = 20,00 мл:
Т(В12) = Т*(В12) ∙Vфот/ Vаликв = 1,97∙10-2∙20,00/2,00 = 0,197 мг/мл.
Ответ: 0,197 мг/мл
Пример 3.4. Никель(II) из водного раствора объемом 100,0 мл экстрагируют в виде диметилглиоксимата 10 мл хлороформа и разбавляют до 20,0 мл хлороформом. Из полученного раствора аликвотные части объемом 5,00 мл фотометрируют методом добавок. Рассчитайте массу никеля(II) в растворе, если оптические плотности хлороформных экстрактов с добавкой 20 мкг никеля и без нее равны соответственно 0,48 и 0,23.
Решение: Рассчитываем массу никеля(II) в фотометрируемом растворе:
m*(Ni)= 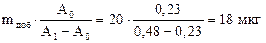 .
.
Рассчитаем массу Ni в исходном растворе, учитывая, что масса никеля в исходном водном растворе равна массе никеля в экстракте.
m(Ni)= 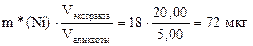
Ответ: 72 мкг
Пример 4.1. Чему равна концентрация (в мкг/мл) раствора рибофлавина, если показание флуориметра для исследуемого раствора 0,60, а для стандартного раствора, содержащего 1,0 мкг/мл рибофлавина, - 0,42?
Решение: Определяем концентрацию рибофлавина в анализируемом растворе по формуле для метода одного стандарта:
Т(X) = 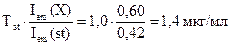
Ответ: 1,4 мкг/мл.
Пример 4.2. Определение алюминия в сплаве проводят по интенсивности люминесценции его соединения с красителем кислотный хром-сине-черный. Навеску сплава массой 0,1200 г растворили и после соответствующей обработки довели объем до 500,0 мл. Затем 10,00 мл этого раствора перенесли в колбу вместимостью 50,00 мл, прибавили раствор кислотного хром-сине-черного и довели объем до метки. Интенсивность люминесценции полученного раствора оказалась равна 75. Интенсивность люминесценции стандартного раствора, содержащего в 100 мл 25,0 мкг Al, равна 65. Определите массовую долю алюминия в сплаве.
Решение: Рассчитываем титр алюминия в стандартном растворе:
Т(Al) = m(Al)/Vр-ра = 25,0/100 = 0,250 мкг/мл.
Определяем титр алюминия в фотометрируемом растворе по формуле для метода одного стандарта:
Т*(Al) = Тст (Al)∙Iem(X) / Iem(cт) = 0,250∙75/65 = 0,29 мкг/мл.
Определяем титр алюминия в исходном растворе:
Т(Al) = Т*(Al) ∙Vфот/ Vаликв = 0,29 ∙50,00/10,00 = 1,4 мкг/мл.
Рассчитываем массу алюминия в навеске и массовую долю в сплаве:
m(Al) = T(Al)∙Vр-ра = 1,4∙500,0 = 700 мкг = 7,0∙10–4 г.
 %(Al) = m(Al)/mнав = 7,0∙10–4/0,1200 = 0,0058 или 0,58%.
%(Al) = m(Al)/mнав = 7,0∙10–4/0,1200 = 0,0058 или 0,58%.
Ответ: 0,58%.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 44314; Нарушение авторских прав?; Мы поможем в написании вашей работы!