
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические сведения. Цель работы: ознакомление с устройством, работой и градуировкой призменного спектроскопа; изучение спектра водорода и определение постоянной Ридберга
|
|
|
|
ИЗУЧЕНИЕ СПЕКТРА ВОДСРОДА И ОПРЕДЕЛЕНИЕ ПОСТОЯННОЙ РИДБЕРГА
Лабораторная работа № 3.2
Цель работы: ознакомление с устройством, работой и градуировкой призменного спектроскопа; изучение спектра водорода и определение постоянной Ридберга.
Оборудование: монохроматор МУМ-5, водородная лампа.
Линейчатые спектры, присущие атомам разреженных газов в простейшем случае (для атоме водорода и водородоподобных систем) хорошо объясняются полуклассической теорией Бора, основанной на трех постулатах.
1й- постулат -: существуют стационарные состояния атомов, находясь в которых атом не излучает энергии. Стационарным состояниям соответствует движение электрона по определенным стационарным орбитам. Находясь на ней, электрон, несмотря на наличие ускорения, не излучает энергии.
2й- постулат -: при переходе атома из, одного стационарного состояния в другое атом излучает (или поглощает) квант энергии. Величина кванта энергии равна разности энергий, соответствующих тем стационарным состояниям, между которыми совершается переход:
 (1)
(1)
где n - частота излучения, h - постоянная Планка, En и Em - энергия атома в стационарных состояниях, между которыми совершается переход;. Если En>Em - атом излучает квант энергии; если En<Em - атом поглощает квант энергии.
3й – постулат –: электрон в атоме движется по таким (стационарным) круговым орбитам, для которых момент импульса электрона 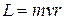 кратен величине
кратен величине 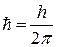
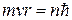 (2)
(2)
где m - масса электрона, v - его скорость, r - радиус круговой стационарной орбиты, n = 1, 2, 3. целое число.
Стационарное состояние, таким образом, характеризуется дискретными (квантованными) значениями энергии Еn и момента импульса Ln. Согласно теории Бора для атома водорода:
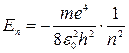 (3)
(3)
где e - заряд электроне.
Тогда частоты спектральных линии атома водорода при переходе с орбиты с энергией Еn2 на орбиту с энергией: En1 будут следующие:
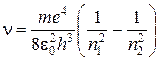 (4)
(4)
Величина 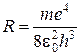 называется постоянной Ридберга для атома водорода. Тогда:
называется постоянной Ридберга для атома водорода. Тогда:
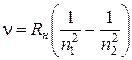 (5)
(5)
|где n1. - номер, стационарного состояния (т.е. энергетического уровня), на который совершается переход, n2, - с которого совершается переход.
При переходе электронов в атоме водорода на орбиту с наименьшей энергией (n 1 = 1) излучается серия линий, лежащих в ультрафиолетовой части спектра (серия Ланмана). При -переходе на орбиту с n1 = 2 излучаются линии серии Бальмера, четыре линяй которой лежат в видимой части спектра.
На рис. 1 числа у коротких стрелок указывают наибольшую длину волны в Å данной серия. По оси указаны значения энергии в электронвольтах.
Следует заметить, что по современным представлениям нельзя говорить об орбитах как о траекториях истинного движения электронов. Движение; электрона описывается с учетом его волновых свойств уравнением Шредингера.
Однако представление о стационарных уровнях энергии атома остается в силе на основе более точной квантовой теории.
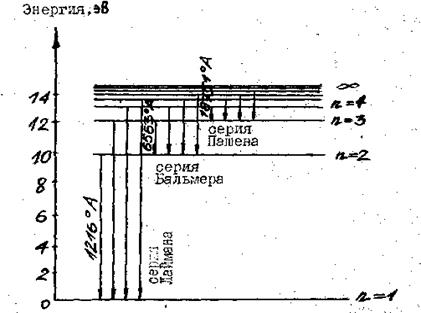
Рис. 1. Схема энергетических, уровней и излучательных переходов для атома водорода
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 407; Нарушение авторских прав?; Мы поможем в написании вашей работы!