
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие сведения о каталитическом методе очистки отходяших газов
|
|
|
|
Методические указания
к выполнению практического задания
«Расчет каталитического реактора»
по дисциплине
«Методы защиты воздушного бассейна»
для студентов специальности 6.040106
«Экология, охрана окружающей среды и сбалансированное природопользование»
дневной и заочной форм обучения
Севастополь
УДК 504.3:628.5
Расчет каталитического реактора: Методические указания к практическому заданию по дисциплине «Методы защиты воздушного бассейна» для студентов специальности 6.040106 «Экология, охрана окружающей среды и сбалансированное природопользование» дневной и заочной форм обучения /Сост. В.В. Макаров, А.А. Павлова. – Севастополь: Изд-во СевНТУ, 2012 - 21 с.
Целью методических указаний является оказание помощи студентам дневной и заочной форм обучения в выполнении практического задания при расчете каталитического реактора по дисциплине «Методы защиты воздушного бассейна». Кратко изложена теоретическая часть метода каталитической очистки, приведен пример расчета каталитического реактора, контрольные вопросы.
Методические указания рассмотрены и утверждены на заседании кафедры «Прикладная экология и охрана труда» СевНТУ (протокол от 2012 года).
Допущено учебно-методическим центром СевНТУ
в качестве методических указаний.
Рецензент В.В. Севриков, профессор, доктор техн. наук.
содержание
Цель работы………………………………………………………………………3
1. Общие сведения о каталитическом методе очистки отходящих газов…….3
2. Конструкция аппаратов……………………………………………………….10
2.1 Контактные аппараты…………………………………………………….10
2.2 Аппараты с взвешенным (кипящим) слоем катализатора……………..12
3. Порядок выполнения работы………………………………………………...15
4. Пример расчета контактного реактора……………………………………...16
5. Индивидуальные задания…………………………………………………….23
6. Контрольные вопросы………………………………………………………...24
Литература………………...……………………………………………………..25
Цель работы: ознакомиться с методикой расчета каталитического реактора и рассчитать реактор по заданию преподавателя.
Каталитические методы являются наиболее перспективными для процессов очистки отходящих газов. Их сущность состоит в том, что под действием специальных веществ, присутствующие в отходящих газах примеси превращаются в нейтральные вещества либо в соединения, легко удаляемые из газовой смеси (экологический катализ). Причем вещества, принимающие активное участие в химической реакции (катализаторы), остаются неизменными после окончания процесса. Преимущество каталитических процессов очистки состоит в том, что они компактны, высокопроизводительны, стабильно обеспечивают высокую степень очистки. К недостаткам большинства каталитических методов следует отнести высокую стоимость катализаторов и невозможность утилизировать примеси из отходящих газов, которые в большинстве случаев разлагаются на нейтральные продукты и выбрасываются в атмосферу с отходящими газами.
В зависимости от агрегатного состояния веществ, участвующих в катализе, каталитические процессы подразделяются на гомогенные и гетерогенные. От вида катализа зависит технология очистки и выбор оборудования. При гомогенном катализе и катализатор, и реагирующие вещества находятся в одной фазе, например, газовой. При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Обычно при очистке газов от примесей в качестве катализаторов используют твердые вещества.
Для того чтобы произошла химическая реакция между атомами, молекулами или ионами, необходимо их непосредственное взаимодействие (столкновение). При температуре 500°С в 1 см3 реакционной смеси происходит 1028 столкновений частиц в секунду. Но не каждое столкновение приводит к химической реакции. Химическая реакция происходит лишь в том случае, когда система обладает необходимым запасом внутренней энергии (активации), если частицы сближаются на расстояние, при котором происходит перекрытие их электронных облаков, а, следовательно, и перераспределение электронных плотностей.
Энергия активации является основным фактором, определяющим скорость каталитической реакции. Чем больше энергия активации, тем меньше частиц обладают в системе такой энергией и тем медленнее протекает реакция. В то же время величина энергии активации значительно меньше энергии, требуемой для разрыва старых связей, она частично компенсируется энергией, освобождаемой при образовании новых. Степень компенсации может быть выражена уравнением:
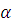 k=
k= 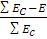 , (1.1)
, (1.1)
где Ec – сумма энергий разрываемых связей; E – энергия активации.
Специфичность процессов каталитической очистки газов состоит в том, что они протекают при малых концентрациях удаляемых примесей. Требования качества окружающей среды предполагают снижение концентрации удаляемого компонента на один, два и более порядков, что усложняет выбор катализаторов и каталитических реакторов. Для правильного выбора катализатора и каталитических реакторов необходимо хотя бы в общих чертах представить механизм каталитического процесса.
Катализ на твердых катализаторах складывается из следующих стадий: внешняя диффузия реагирующих веществ в поверхности катализатора, внутренняя диффузия в порах зерна катализатора; активированная (химическая) адсорбция одного или нескольких реагирующих компонентов на поверхности катализатора, перегруппировка атомов (химическая реакция); обратная диффузия продукта в порах зерна катализатора; диффузия продуктов от поверхности зерна.
Каждая из стадий каталитического процесса должна обладать энергией активации, значительно меньшей, чем энергия активации реакции в отсутствии катализатора, иначе каталитический процесс окажется энергетически невозможен. Общая скорость каталитического процесса определяется относительными скоростями отдельных стадий и может лимитироваться наиболее медленной из них. Различают процессы, протекающие в кинетической внешнедиффузионной и внутридиффузионной областях.
Во внешнедиффузионной области суммарная скорость каталитического процесса лимитируется скоростью подвода (диффузии) реагирующих веществ в зону реакции. При этом предполагается, что химическая реакция протекает мгновенно. Скорость каталитических процессов, протекающих в внешнедиффузионной области, можно увеличить путем увеличения макропор (наружной поверхности) катализатора и перемешиванием реагентов.
Скорость диффузии определяют, используя первый закон Фика:
Uд= 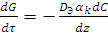 , (1.2)
, (1.2)
где G – количество вещества, перенесенного за время τ в направлении, перпендикулярном к поверхности зерна катализатора;
DЭ – суммарный коэффициент эффективной диффузии в газовой среде, рассчитывается с учетом молекулярной и турбулентной диффузии;
αk – внешняя поверхность зерен катализатора;
dC/dz – градиент концентрации.
Коэффициент молекулярной диффузии в газовой фазе определяют по уравнению:
Dг=  , (1.3)
, (1.3)
где МА, МВ – мольные массы вещества А и В, г/моль;
VA, VB – мольные объемы вещества А и В, см3/моль;
Р – общее давление (0,1 МПа);
СА+В – константа Сезерленда,
СА+В=1,4φ(Т′АТ′В), (1.4)
где Т – температура кипения компонентов А,В, К,
φ=8 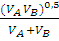 . (1.5)
. (1.5)
При VA≈VB коэффициент φ равен 1. Коэффициент турбулентной диффузии определяют экспериментально.
Во внутридиффузионной области суммарная скорость каталитического процесса лимитируется скоростью подвода реагирующих веществ в зону реакции в микропорах зерна катализатора. Увеличить скорость таких процессов можно путем уменьшения размеров зерна катализатора или увеличением внутренней поверхности катализатора, создаваемой тонкими порами малой длины. Время τ диффузии компонента в поры катализатора на глубину l определяют по формуле Эйнштейна:
τ= 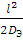 . (1.6)
. (1.6)
Если длина свободного пробега молекулы компонента λ меньше диаметра поры (λ<2r), то DЭ=Dг. При стесненном режиме, когда λ>2r, коэффициент эффективной диффузии определяют по формуле:
DЭ= 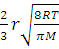 , (1.7)
, (1.7)
где r- радиус поры.
При λ=2r: DЭ=Dг(1-e2r/λ). (1.8)
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 815; Нарушение авторских прав?; Мы поможем в написании вашей работы!