
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Линейчатый спектр атома водорода
|
|
|
|
Исследования спектров излучения разряженных газов (то есть спектров излучения отдельных атомов) показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома - атома водорода.
Швейцарский ученый И. Бальмер подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
 (n=3,4,5…), (7.2)
(n=3,4,5…), (7.2)
где R /=1,10×107 м-1 – постоянная Ридберга. Так как V=c/l, то формула (7.2) может быть переписана для частот:
 (n=3,4,5…), (7.3)
(n=3,4,5…), (7.3)
где R = R/ с = 3,29×1015 с-1 – также постоянная Ридберга.
Из выражений (7.2) и (7.3) вытекает, что спектральные линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серией Бальмера. С увеличением n линии серии сближаются; значение 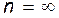 определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.
определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.
В дальнейшем в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:
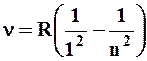 (n=2,3,4,…)
(n=2,3,4,…)
В инфракрасной области спектра были обнаружены:
серия Пашена:
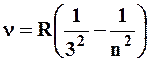 (n=4,5,6,…)
(n=4,5,6,…)
серия Брэкета:
 (n=5,6,7,…)
(n=5,6,7,…)
cерия Пфунда:
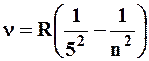 (n=6,7,8…)
(n=6,7,8…)
серия Хемфри:
 (n=7,8,9…).
(n=7,8,9…).
Все приведенные серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:
 , (7.4)
, (7.4)
где m имеет в каждой данной серии постоянное значение, m =1,2,3,4,5,6, (определяет серию); n принимает целочисленные значения с m+1 (определяет отдельные линии этой серии).
Исследование более сложных спектров – спектров паров щелочных металлов (например, Li, Na, К) – показало, что они представляются набором незакономерно расположенных линий. Ридбергу удалось разделить их на три серии, каждая из которых располагается подобно линиям бальмеровской серии. Приведенные сериальные формулы подобраны эмпирически и долгое время не имели теоретического обоснования, хотя и были подтверждены экспериментально с очень большой точностью. Вид этих формул, удивительная повторяемость в них целых чисел, универсальность постоянной Ридберга свидетельствуют о глубоком физическом смысле найденных закономерностей, вскрыть который в рамках классической физики оказалось невозможным.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1017; Нарушение авторских прав?; Мы поможем в написании вашей работы!