
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Проекты-решения
|
|
|
|
Четыре требования к выполнению полного воссоздания мозга являются весьма жесткими. Но есть и осуществимые решения, удовлетворяющие этим требованиям и применяющие последние достижения науки и приборостроения. Прямо сейчас на этапе разработки и воплощения находится целый ряд проектов (подробнее об этом смотрите на сайте carboncopies.org и в статье Рэндала Куне «Экспериментальные исследования в области полного моделирования мозга», которая выйдет в журнале International Journal of Machine Consciousness, в специальном выпуске 2012 года).
Очевидно, чтобы построить структурный коннектом, нам следует обратиться к пространственной структуре клеток и тканей мозга. Электронные микроскопы предоставляют необходимое для этих целей высокое разрешение, в то время как автоматическое деление мозга на части задает нужный масштаб изображений. Сегодня объемная микроскопия активно развивается рядом научных коллективов (один из проектов такого рода – ATLUM Project Гарвардского университета).
Принципиально иной подход к строительству коннектома заключается в том, чтобы помечать связи между пресинапсами и постсинапсами с помощью «биологических штрих-кодов» – искусственных секвенций ДНК и РНК. Пометки образуют двунаправленные указатели между нейронами. После извлечения пометок сеть указателей представляет из себя структурный коннектом, состоящий из связей между нейронами. Биологические инструменты для реализации данного проекта разрабатываются в лабораториях Энтони Зэйдора (Dr. Anthony Zador) и Эда Кэллоуэя (Dr. Ed Callaway).
Функциональная характеризация элементов in vivo требует особо высокого разрешения, и мы пристально следим за разработкой соответствующих инструментов. Один из способов добиться необходимого разрешения и масштаба – создать иерархию интерфейсов, сообщающих о сигналах, проходящих через демультиплексор. Сюзанна Гилдерт (Suzanne Gildert) называет этот подход «древом демультиплексора». Рудольфо Льинас (Rodolpho Llinas) приводит пример такого дерева: границы между его узлами образованы нанопроволочками, доставка которых осуществляется через кровеносную систему мозга. Эти гибкие нанопроволоки были разработаны в Медицинской школе Нью-Йоркского университета (New York University School of Medicine), их диаметр – 500 нанометров. На данный момент далеко не все части мозга удалось охватить нанопроволоками, в древо демультипликатора они пока тоже не включены.
Также существует ряд проектов, занятых разработкой биологических инструментов, работающих как на клеточном, так и на субклеточном уровнях нервной ткани и выполняющих огромное количество операций в единицу времени. Гарвардский университет, Северо-западный университет (Northwestern University) и Массачусетский технологический институт при участии Halcyon Molecular сотрудничают над созданием инструментария, получившего название «молекулярная телеграфная лента». Функциональные события (например, активация рецепторов, чувствительных к изменению мембранного потенциала) записываются на биологические источники информации, такие как ДНК. Запись информации происходит прямо в клетках и впоследствии может быть извлечена из них.
Точное воссоздание биологических процессов при отсутствии нежелательных взаимодействий и побочных эффектов – весьма нетривиальная задача. Найти биофизические компоненты, способные считывать сигналы, включить эти компоненты в систему и разработать стратегии для достоверной записи сигналов – эта работа требует огромного количества времени, усилий и дальнейших исследований. При этом разрешение и масштаб существующих биологических инструментов являются в высшей степени обнадеживающими. Особенно соблазнительной является возможность чтения сигналов in vivo. Эта цель пока еще не достигнута.
Если мы соединим вместе преимущества обоих подходов, то это позволит работать на субклеточном уровне, записывать сигналы in vivo и при этом иметь дело только с узлами (а не с физическими характеристиками) демультиплексного древа. Оптимальный способ достижения этой цели, который был придуман еще десятилетия назад Эриком Дрекслером (Eric Drexler), Ральфом Мерклом (Ralph Merkle), Робертом Фрайтасом (Robert Freitas) и другими, – это нанороботы. Нанотехнологии – довольно новая дисциплина; нам пока далеко не все удается в создании роботов и обычного размера. В чем наука и техника достигли немалых успехов – так это в создании микросхем. В «Примечании 2» вашему вниманию будет представлен проект под названием «Микро-нейроинтерфейс» (Micro-Neuro-Interface).
Функции сознания выполняются высокопараллельными сетями мозга, состоящими из преимущественно безмолвных процессоров малой мощности – нейронов. Для успешного воспроизведения этих функций нужна схожая вычислительная среда. Именно поэтому разработка нейроморфных компьютерных платформ представляет для нас столь большой интерес. Работами данного рода является проект DARPA под названием SyNAPSE Project; микрочип Гая Пайлета (Guy Paillet), в архитектуре которого заложены возможности дальнейшего развития, а также европейские проекты CAVIAR и FACETS.
Примечание 1. Объемная микроскопия
Весьма оптимистичными являются достижения электронной микроскопии в сборе структурированных данных. В 2011 году в журнале Nature вышла статья Кевина Бриггмана (Kevin Briggman) со сравнением реконструкции, сделанной с помощью растрового электронного микроскопа SBFSEM, с функциональной записью, произведенной в той же ткани. Другая публикация в Nature, принадлежащая Дэви Боку (Davi Bock) описывала применение того же метода для анализа нейронных сетей в зрительной коре головного мозга. Результаты работы Бока и Бриггмана впечатляют, однако следует признать, что технология микроскопов SBFSEM обладает рядом ограничений с точки зрения объема мозга, с которым она способна работать.
Над решением данной проблемы работает доктор Кен Хейворт (Ken Hayworth). В лаборатории Джеффа Лихтмана (Jeff Lichtman) он создал устройство под названием «автоматический токарный ультрамикротом с лентой» (Automatic Tape-Collecting Lathe Ultramicrotomes, сокращенно ATLUMs). Этот прибор (на котором мозг вращается, как на токарном станке. – Прим. пер.) позволяет срезать большие объемы ткани, помещать их на ленту и хранить данные в библиотеке. Разрешение этих изображений настолько высоко, что позволяет увидеть пузырьки, несущие нейротрансмиттеры от синапса к синапсу (изображение демонстрирует силу синаптической связи, см. Рис. 3).
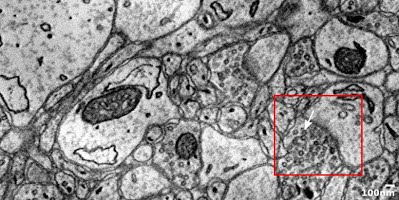
Рис. 3. На этом электронном микроснимке мозжечка ясно видно расположение синапсов (темная линия внутри красного квадрата) и даже пузырьков, переносящих нейротрансмиттеры (на них указывает белая стрелка).
Таким образом, трехмерная реконструкция может быть выполнена без потерь структурной информации. На рисунке мы четко видим отдельные нейроны, синаптические связи, подробную морфологию аксонов и дендритов в нейронной сети. Очень важно понимать, что речь идет не о футуристических прогнозах, а о реально существующих приборах, которые удовлетворяют требованиям проекта по полному воссозданию мозга (см. статью Бриггмана в Nature, выпуск 471, 2011 год). Эти приборы следовало бы усовершенствовать так, чтобы они эффективно справлялись с б о льшим объемом тканей, но это вполне решаемая технологическая задача. Я не вижу непреодолимых препятствий на пути скорого научного прорыва в данной сфере.
Примечание 2. Микро-нейроинтерфейсы
Знания в области создания интегральных микросхем позволяют нам строить сложные иерархические системы, обрабатывать сигналы, создавать коммуникационные и вычислительные сети. Работа с триггерными событиями не требует много энергии, ее источником могут служить инфракрасное излучение, электромагнитная индукция или клеточное биотопливо из глюкозы (Ф.Санкен и соавторы, 2010) (Philippe Cinquin et al.).
Микро-нейроинтерфейс размером с эритроцит (8 микрон в диаметре) будет состоять из функциональной схемы (Рис. 4) и контактов, обеспечиваться энергией инфракрасного излучения и обладать антенной для радиочастотной идентификации. Метод пассивной инфракрасной коммуникации под названием micro-OPID разрабатывается Яэлем Магуайром (Yael Maguire). Micro-OPID – это микрочип размером 32 нанометра, который имеет 2300 транзисторов (такое же число транзисторов было в микропроцессоре Тьюринга для Intel 4004) и может путешествовать по кровеносным сосудам мозга, питающим каждый нейрон. 22-нанометровая технология 2011 года позволит микрочипу содержать в 4 раза больше транзисторов (такое же количество, как в системе наведения крылатых ракет).

Рис. 4. Схематическое изображение микро-нейроинтерфейса с биосовместимым покрытием.
Микросхема, встроенная в микро-нейроинтерфейс, будет заключена в оболочку из биосовместимого или биоактивного материала. Несмотря на то что силикон вполне удовлетворяет данным требованиям, хотелось бы отметить, что еще в 2009 году Нишиту Доши и коллегам (Nishit Doshi et al.) удалось сделать покрытие для искусственных клеток крови из белка. Таким образом, соединение искусственной микросхемы и биосовместимого покрытия даст нам микро-нейроинтерфейс величиной с эритроцит.
Но даже 8 микрон – неидеальный размер, ведь наш чип не способен сжиматься, как это делает клетка крови, в то время как хотелось бы, чтобы он был способен проникать не только в кровеносные сосуды, но и в межклеточное пространство. Доктору Родриго Гомесу-Мартинесу и его коллегам (Rodrigo Gomez-Martinez et al.) удалось создать чипы меньшего размера (они могут внедряться в сами клетки), мы можем последовать его примеру. Некоторые наши чипы будут способны улавливать определенные сигналы, например электрический ток; другие смогут стимулировать или направлять соседние чипы; третьи будут объединяться, чтобы пометить ту или иную структуру.
По сути, чипы представляют из себя иерархическую систему с узлами величиной с клетку. Это иерархическое облако измеряющих и регистрирующих компьютеров. Свою работу они смогут выполнять как снаружи, так и внутри кровеносных сосудов. Устройства с функциональными покрытиями, такими как нанолипучки, созданные Сарой Дюран и коллегами (Sara Duran et al.), могут вступать во взаимодействие с клеточными мембранами. Более крупные кластеры устройств будут распределять энергию и аккумулировать данные для доставки вовне. С такими приборами нам откроется множество новых типов измерений.
Если мы сможем создать микро-нейроинтерфейс величиной 2 микрона для каждого из 86–100 млрд нейронов, снабдив каждый десяток нейроинтерфейсов одним хабом величиной 8 микрон – в таком случае все чипы, собранные вместе, займут не более 1 куб.см, или 1/1700 всего объема мозга. Таким образом, древо демультиплексора становится иерархическим обрабатывающим информацию облаком, которое действует в едином пространстве и времени с нейронной сетью мозга.
|
|
|
|
|
Дата добавления: 2015-07-01; Просмотров: 560; Нарушение авторских прав?; Мы поможем в написании вашей работы!