
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вода и неорганические соединения, их роль в клетке
|
|
|
|
Содержание химических элементов в клетке. Макро-, микро - и ультрамикроэлементы.
Клетка это сложная саморегулирующаяся система, в которой одновременно и в определенной последовательности происходят сотни химических реакций, направленных на поддержание ее жизнедеятельности, роста и развития. Изучение химического состава клеток показывает, что в живых организмах нет никаких особых химических элементов, свойственных только им: именно в этом проявляется единство химического состава живой и неживой природы.
Из 115 существующих в природе химических элементов активное участие в процессах жизнедеятельности принимают не менее их половины. Причем 24 из них являются обязательными и обнаруживаются почти во всех типах клеток, а наибольшее значение имеют 10 элементов – азот (N), водород (H), углерод (C), кислород (O), фосфор (P), сера (S), натрий (Na), калий (K), кальций (Ca), магний (Mg) – из них построены основные компоненты клетки.
По процентному содержанию в клетке химические элементы делятся на три группы:
· макроэлементы, содержание в клетке - 10-3; кислород, углерод, водород, азот, фосфор, сера, кальций, калий, хлор, натрий и магний, составляющие свыше 99% массы клетки;
· микроэлементы, содержание которых колеблется в пределах 10-3-10-6; железо, марганец, медь, цинк, кобальт, никель, йод, бром, фтор, бор; на их болю приходится 1,0% массы клетки;
· ультрамикроэлементы, составляющие менее 10-6; золото, серебро, уран, бериллий, цезий, селен и др.; в сумме – менее 0,1% массы клетки.
Несмотря на низкое содержание в живых организмах микро - и ультрамикроэлементы играют важную роль: они входят в состав различных ферментов, витаминов и обусловливают тем самым нормальное развитие и функционирование структур клетки и организма в целом.
Каждый из химических элементов, встречающихся в живых организмах, выполняет важную функцию (таблица…).
Химические элементы в клетках находятся в виде ионов, в составе неорганических или органических веществ.
Неорганические (минеральные) вещества – это относительно простые химические соединения, которые встречаются как в живой, так и в неживой природе (в минералах, природных водах). Из неорганических соединений важное значение имеют вода, минеральные соли, кислоты и основания.
Вода.
Среднее содержание воды в клетках большинства организмов составляет около 70% (в клетках медузы – 96%). Количество воды в различных органах и тканях варьирует и зависит от уровня их обменных процессов. Так, у человека содержание воды в клетках зубной эмали – 10%, костной ткани – 20%, жировой ткани – 40%, почек – 80%, головного мозга – до 85%, а в клетках эмбриона - до 97%.
Такое высокое содержание воды – свидетельство её важной в клетках живых организмов роли, обусловленной ее строением. Молекулы воды имеют малые размеры и нелинейную
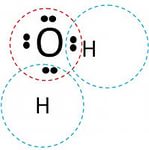 Рис. Формула воды.
Рис. Формула воды.
пространственную структуру. Атомы в молекуле удерживаются посредством полярных ковалентных связей, которые связывают один атом кислорода с двумя атомами водорода. Полярность ковалентных связей, т.е. неравномерное распределение зарядов, объясняется в данном случае сильной электроотрицательностью атома кислорода, который оттягивает на себя электроны из общих электронных пар, вследствие чего на атоме кислорода возникает частичные отрицательный заряд, а на атомах водорода – частичный положительный. Между атомами кислорода и водорода соседних молекул воды возникают водородные связи, благодаря чему при нормальных условиях вода имеет исходное жидкое состояние. Однако, водородные связи по прочности слабее ковалентных примерно в 20 раз, поэтому легко разрываются при испарении воды.
Свойства воды:
- универсальный растворитель – в воде растворяются полярные неорганические и органические соединения; вещества, хорошо растворимые в воде (многие минеральные соли, кислоты, щелочи, спирты, сахара, витамины, некоторые белки – альбумины, гистоны), называют полисахариды, жиры, нуклеиновые кислоты, некоторые белки – глобулины, фибриллярные), гидрофильными; вещества плохо или вовсе не растворимые в воде (некоторые соли, витамины, называют гидрофобными.
- высокая удельная теплоемкость – способность поглощать теплоту при минимальном изменении собственной температуры; при испарении воды для разрыва водородных связей, удерживающих молекулы, требуется поглотить большое количество энергии, поэтому, испаряя воду, организмы могут защитить себя от перегрева.
- высокая теплопроводность – равномерное распределение теплоты между тканями организма.
- высокое поверхностное натяжение – имеет важное значение для адсорбционных процессов, для передвижения растворов по тканям (кровообращение у животных, восходящий ток у растений), удержание на поверхности или скольжение по поверхности воды мелких организмов.
- вода практически не сжимается, создавая тургорное давление, в основе которого лежат явления осмоса, и, определяя объем и упругость клеток и тканей.
Осмос – проникновение молекул растворителя (воды) через биологическую мембрану в раствор вещества. Осмотическое давление – давление, с которым растворитель проникает через мембрану. Величина осмотического давления возрастает с увеличением концентрации раствора. Осмотическое давление жидкостей человеческого организма равно давлению 0,85% раствора хлорида натрия, т. е. изотонического раствора. Более концентрированные растворы называют гипертоническими, а менее концентрированные – гипотоническими.
Вода находится в клетке в свободной и связанной формах. Связанная вода – 4-5% - входит в состав фибриллярных структур, и соединятся с некоторыми белками, образуя вокруг них сольватную оболочку. Свободная вода – 95-96% - выполняет целый ряд биологически важных функций.
Функции воды:
1) транспортная – обеспечивает передвижение веществ в клетке и организме, поглощение
2) метаболическая – является средой для всех биохимических реакций в клетке;
3) структурная – цитоплазма клетки содержит от 60% до 95% воды; у растений вода обеспечивает тургор; у круглых и кольчатых червей является гидростатическим скелетом.
Неорганические вещества.
Подавляющая часть неорганических веществ находится в виде солей – либо диссоциированных на ионы, либо в твердом состоянии.
Неорганические ионы имеют немаловажное значение для обеспечения процессов жизнедеятельности клетки – это катионы (K+, Na+, Ca2+, Mg2+, NH3+) и анионы (Cl-, HPO42-, H2PO4-, HCO-, NO3-) минеральных солей. Содержание катионов и анионов в клетке отличается от их концентрации в среде, окружающей клетку, вследствие активной регуляции переноса веществ мембраной. Таким образом, обеспечивается постоянство химического состава живой клетки. С гибелью клетки концентрация веществ в среде и в цитоплазме выравнивается.
Содержащиеся в организме ионы имеют важное значение для поддержания постоянства реакции среды (рН) в клетке и в окружающих ее растворах, т.е. являются компонентами буферных систем. Буферность – способность клетки поддерживать слабощелочную реакцию своего содержимого на постоянном уровне. Анионы слабых кислот и слабые щелочи связывают ионы Н+ и гидроксил-ионы (ОН-), благодаря чему реакция внутри клетки практически не меняется. Буферные свойства клетки зависят от концентрации солей. Наиболее значимые буферные системы млекопитающих – фосфатная и бикарбонатная.
Фосфатная буферная система – состоит из H2PO4- и HPO42- и поддерживает рН внутриклеточной жидкости в пределах 6,9-7,4. Главной буферной системой внеклеточной среды (плазмы крови) служит бикарбонатная система, состоящая из H2CO3 и HCO3- и поддерживающая рН на уровне 7,4.
Неорганические кислоты и их соли имеют важное значение в жизнедеятельности организмов:
- соляная кислота входит в состав желудочного сока;
- остатки серной кислоты, присоединяясь к нерастворимым в воде чужеродным веществам, делают их растворимыми, способствуя выведению из организма;
- неорганические натриевые и калиевые соли азотистой и фосфорной кислот, кальциевая соль серной кислоты служат компонентами минерального питания растений (в качестве удобрений);
- соли кальция и фосфора входят в состав костной ткани животных.
Органические вещества – многочисленные соединения углерода, синтезируемые преимущественно живыми организмами.
Соотношение химических элементов в живых телах иное, чем в объектах неживой природы. В земной коре наиболее распространены Si, Al, O2, Na – 90%. В живых организмах: H, O, C, N – 98%. Такое различие обусловлено особенностями химических свойств водорода, кислорода, углерода и азота, вследствие чего они оказались наиболее подходящими для формирования молекул, выполняющих биологические функции.
Водород, кислород, углерод и азот способны образовывать прочные ковалентные связи посредством спаривания электронов, принадлежащих двум атомам. Кислород, углерод и азот образуют и одинарные, и двойные связи, благодаря чему получаются самые разные химические соединения. Особенно важна способность атомов углерода взаимодействовать друг с другом путем возникновения ковалентных углерод-углеродных связей. Каждый углеродный атом может установить ковалентные связи с четырьмя атомами углерода. Ковалентно связанные атомы углерода могут формировать каркасы бесчисленного множества органических молекул. Поскольку атомы углерода легко вступают в ковалентные связи с кислородом, азотом и серой, органические молекулы достигают исключительной сложности и разнообразия строения.
Органические соединения составляют в среднем 20-30% массы клетки живого организма. Различают: мономеры – малые низкомолекулярные органические молекулы, которые служат строительными блоками для полимеров; полимеры – более крупные, высокомолекулярные макромолекулы.
Полимеры представляют собой линейные или разветвленные цепи, содержащие большое число мономерных звеньев. Гомополимеры – представлены одним видом мономеров (целлюлоза), гетерополимеры – несколькими различными мономерами (белок, ДНК, РНК). Если в молекуле группа мономеров периодически повторяется, то полимер называют регулярным, в молекулах нерегулярных полимеров видимой повторяемости нет.
К органическим веществам относятся биополимеры – белки, нуклеиновые кислоты и углеводы; а также жиры.
В различные типы клеток входит неодинаковое количество тех или иных органических соединений (в растительных клетках преобладают сложные углеводы – полисахариды; в животных – больше белков и жиров). Тем не менее, каждая группа органических веществ в любом типе клеток выполняет сходные функции.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 2371; Нарушение авторских прав?; Мы поможем в написании вашей работы!