
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия
|
|
|
|
Наступит тепловая смерть Вселенной.
Принцип возрастания энтропии приводит к мысли (Клаузиус), что энтропия Вселенной приближается к максимуму, по достижении которого во Вселенной прекратятся какие бы то ни были процессы. Должно наступить абсолютно равновесное состояние, в котором никакие процессы уже невозможны.
Энтропия и тепловая смерть.
В настоящее время установлено, что вывод о «тепловой
смерти» Вселенной и первоначальные попытки его опровержения являются несостоятельными, поскольку в них не учитывалось влияние тяготения. Выяснилось, что из-за тяготения однородное изотермическое распределение вещества во Вселенной не соответствует максимуму энтропии, поскольку такое состояние не является наиболее вероятным.
Вселенная нестационарна — она расширяется, и первоначально однородное вещество распадается под действием сил тяготения, образуя скопления галактик, сами галактики, звезды и т.д. Эти процессы происходят с ростом энтропии — в соответствии со вторым началом термодинамики. И ниоткуда не следует, что эти процессы приведут к однородному изотермическому состоянию Вселенной, т.е. к «тепловой смерти» Вселенной.
Любым частицам (молекулам, атомам, ионам) присуще стремление к беспорядочному движению, поэтому система стремится перейти из более упорядоченного состояния в менее упорядоченное. Количественный мерой беспорядка является энтропия 5. Изменение энтропии ∆5 в изолированной системе, переходящей из состояния 1 в состояние 2, можно определить соотношением:
∆5=R1пW2/W1,
где R- универсальная газовая постоянная;
W1.W2 - параметры беспорядка соответственно в состояниях 1 и 2.
W - термодинамическая вероятность состояния системы, определяющая общее число микросостояний частиц в системе (мгновенные координаты каждой частицы - х„ уь г1 и мгновенные скорости перемещения частиц по
всем координатам V-x1, У-у1, У-z1 c помощью которых осуществляется данное макросостояние (р, Т, U).
Энтропия - термодинамическая функция состояния системы и ее вели-
чина зависит от количества рассматриваемого вещества (массы), температу-ры, агрегатного состояния.
Проследим изменение энтропии при росте температуры на примере
воды| (рис. 4.1).
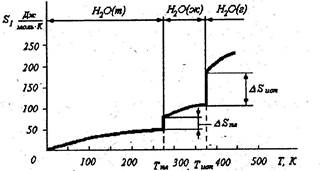
Рис. 4 1 - Изменение энтропии воды с ростом температуры
При температуре ниже Т= 273 К вода находится в твердом кристалли-ческом упорядоченном состоянии, характеризующемся низкой энтропией. С ростом температуры возрастают колебания молекул воды в кристаллической решетке льда, увеличивается термодинамическая вероятность системы и, следовательно, энтропия системы. При температуре плавления нарушается кристаллическая структура льда, резко повышается термодинамическая вероятность системы, скачком растет энтропия. При нагреве воды возрастают тепловые скорости молекул, интенсивность их взаимного перемещения, растет энтропия. Наконец, при температуре кипения переход из жидкого в парообразное состояние приводит к резкому скачкообразному возрастанию энтропии. Дальнейшее повышение температуры пара ведет к еще большему росту энтропии.
Таким образом у газообразных веществ энтропия выше, чем у жидких, у жидких выше, чем у кристаллических. Изменение энтропии при фазовых переходах определяется:
при плавлении ∆S = ∆H пл при испарении ∆S = ∆H исп
T пл T исп
где ∆Hпл и ∆H исп - соответственно удельные теплоты плавления и испарения.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 314; Нарушение авторских прав?; Мы поможем в написании вашей работы!