
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Качественная оценка накипеобразующей способности воды
|
|
|
|
Отложения, образующиеся на внутренних поверхностях водогрейного оборудования, относятся к классу так называемых низкотемпературных. Основным компонентом таких отложений является карбонат кальция. В зависимости от химического состава исходной воды и конкретных условий работы оборудования в отложениях могут присутствовать окислы железа, сульфат кальция, силикаты и другие составляющие.
Движущей силой процесса образования твердой фазы карбоната кальция (СаСО3) в воде является пересыщение по этому соединению. Это явление может быть представлено как превышение произведения активностей (активных концентраций) ионов кальция и карбонатных ионов ( ) произведения растворимости карбоната кальция (
) произведения растворимости карбоната кальция (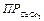 ):
):
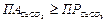 ,
,
Наличие пересыщения воды по карбонату кальция может быть установлено путем сравненияреального значения произведения активностей ионов кальция и карбонатных ионов ( ), вычисленного с учетом ионной силы водного раствора, с величиной произведения растворимости карбоната кальция (
), вычисленного с учетом ионной силы водного раствора, с величиной произведения растворимости карбоната кальция (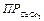 ):
):
 или <
или < 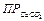
Значения 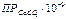 для разной температуры нагрева воды приведены в таблице 3:
для разной температуры нагрева воды приведены в таблице 3:
Таблица 3
| Темпе- ратура, °С | |||||||||
 , 10-9 , 10-9
| 5,22 | 3,93 | 3,03 | 2,37 | 1,83 | 1,35 | 1,02 | 0,47 | 0,005 |
а) Для проведения расчетов необходимо учесть процесс термического разложения бикарбонатов, происходящий при нагревании воды. В условиях нормальной работы водогрейного оборудования вода в процессе нагревания не вскипает, поэтому разложение бикарбонат-ионов происходит без отвода из системы газообразной углекислоты и может быть описано уравнением:
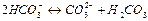
Отсюда следует, что концентрацию карбонатных ионов, образовавшихся в результате термического разложения бикарбонат-ионов, можно определить по формуле:
 ,
,
где  и
и 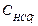 - концентрации ионов, мг/дм3;
- концентрации ионов, мг/дм3; 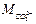 и
и 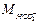 - массы ионов, определенные с помощью таблицы Менделеева.
- массы ионов, определенные с помощью таблицы Менделеева.
б) Используя полученные по результатам химического анализа концентрации всех содержащихся в воде ионов, можно определить ионную силу раствора и коэффициенты активностей ионов кальция и карбонатных ионов;
1) Для проведения расчетов необходимо выразить концентрацию всех ионов в специальных (используемых для расчета) единицах - в грамм-ионах на кубический дециметр воды (г-ион/дм3). Для этого надо умножить все значения концентраций ионов, выраженных в миллиграммах на кубический дециметр воды (мг/ дм3), на 10-3 и разделить на ионную (молекулярную) массу:
 ,
,
где М – масса каждого иона, определенная с использованием таблицы Менделеева.
2) Ионную силу раствора в грамм-ионах на кубический дециметр воды определяют по формуле:

где Сион – концентрация иона, г-ион/дм3; Zион – валентность иона, найденная по таблице Менделеева.
Коэффициенты активности двухвалентных ионов кальция и карбонат-ионов (они совпадают по величине) находят по таблице 4 или используя формулу:
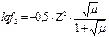
Таблица 4
µ,

| 0,001 | 0,002 | 0,005 | 0,01 | 0,02 | 0,05 | 0,1 | 0,2 |
| f2 | 0,87 | 0,82 | 0,74 | 0,66 | 0,58 | 0,44 | 0,33 | 0,24 |
в) Активности (активные концентрации) ионов кальция и карбонат-ионов находят по формулам:
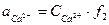 ,
,
 ,
,
где 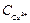 и
и  - фактические концентрации ионов, г-ион/дм3.
- фактические концентрации ионов, г-ион/дм3.
г) Произведение активностей ионов кальция и карбонат-ионов находят из выражения:

д) Условие теоретической невозможности появления карбонатной накипи запишется как: 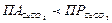 . При условии:
. При условии: 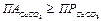 вода пересыщена по карбонату кальция и существует потенциальная возможность образования карбонатной накипи.
вода пересыщена по карбонату кальция и существует потенциальная возможность образования карбонатной накипи.
Для качественной оценки накипеобразующей способности природной воды предложен показатель, названный кристаллизационным напором. Он представляет собой соотношение:

При углекислотном равновесии кристаллизационный напор равен единице. Ненасыщенный раствор карбоната кальция характеризуется значением  . При
. При  раствор пересыщен по этому соединению, и вода с таким показателем может быть причиной карбонатного накипеобразования в оборудовании, где происходит ее нагревание.
раствор пересыщен по этому соединению, и вода с таким показателем может быть причиной карбонатного накипеобразования в оборудовании, где происходит ее нагревание.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 674; Нарушение авторских прав?; Мы поможем в написании вашей работы!