
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константы равновесия химических реакций
|
|
|
|
Обратимом окислении топлив.
До сих пор рассматривался необратимый процесс горения в результате которого химическая энергия топлива преобразовывалась в тепловую энергию рабочего тела. Из термодинамики известно, что максимальный коэффициент преобразования тепловой энергии в работу или электрическую энергию достигается в обратимых процессах. Сказанное относится и к процессу преобразования энергии химического топлива в работу. Рассмотрение обратимых процессов в химических превращениях основывается на применении второго начала термодинамики. Рассмотрим химическую реакцию
 . (2.4.1)
. (2.4.1)
В условиях равновесия скорость ее протекания слева направо равна скорости обратной реакции справа налево. Согласно закону действующих масс скорость химической реакции пропорциональна произведению
концентраций реагирующих веществ. В данном случае
 ,
,
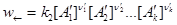 ,
,
где k1, k2 - константы, зависящие от температуры. Когда наступает
равновесие,  , или
, или
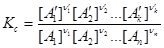 (2.4.2)
(2.4.2)
где 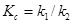 - константа равновесия, зависящая только от температуры. Таким образом в условиях равновесия отношение произведения концентраций продуктов реакции к произведению концентраций реагирующих
- константа равновесия, зависящая только от температуры. Таким образом в условиях равновесия отношение произведения концентраций продуктов реакции к произведению концентраций реагирующих
веществ равно константе равновесия химической реакции, зависящей
только от температуры.
Обычно в качестве концентрации вещества А берут число его молей
в единице объема, т.е. размерность [ А ] равна кмоль/м или моль/см.
Формула (2.4.2) позволяет найти состав смеси реагирующих химических веществ, если константа равновесия известна. Рассмотрим пример. Найдем состав смеси равновесной реакции

если Кс = 1 и в начале реакции в смеси был 1 моль СО и 1 моль Н2О.
Решение. Обозначим через x число молей углекислого газа в единице объема, тогда из уравнения реакции следует, что концентрация СО равна 1-x, концентрация водорода равна концентрации углекислого
газа, т.к. они образуются совместно. Соответственно концентрация
паров воды равна 1-x. Воспользуемся теперь условием равновесия
(2.4.2), из которого следует, что
x*x/(1-x)(1-x) = 1,
откуда x = 0,5. Таким образом в условиях равновесия концентрации
всех реагирующих веществ одинаковы и составляют 0,5 кмоля на куб.
Обычно измеряются не концентрации реагирующих веществ а их парциальные давления. Так определяется константа равновесия
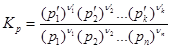 (2.4.3)
(2.4.3)
которая связана с константой Кс некоторым соотношением. Найдем его в
предположении, что реагирующие газы являются идеальными, а, следовательно, подчиняются уравнению состояния:
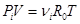 ,
,
где R0 - универсальная газовая постоянная. Из уравнения следует, что
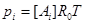 ,
,
где 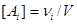 - мольная концентрация i -ой компоненты. Подставляя
- мольная концентрация i -ой компоненты. Подставляя
это выражение в (2.4.3), найдем
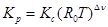 .
.
|
|
|
|
|
Дата добавления: 2015-06-27; Просмотров: 488; Нарушение авторских прав?; Мы поможем в написании вашей работы!