
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение. Динамика по содержанию тяжелых металлов в речной рыбе, обитающей в поверхностных водотоках Биробиджанского района ЕАО за 2010-2012 гг
|
|
|
|
Динамика по содержанию тяжелых металлов в речной рыбе, обитающей в поверхностных водотоках Биробиджанского района ЕАО за 2010-2012 гг.
Методика определения содержания тяжелых металлов в рыбе
В санитарно-гигиенической лаборатории Россанэпиднадзора используется способ минерализации проб пищевых продуктов и продовольственного сырья с использованием аналитических автоклавов для последующего определения содержания токсичных элементов (меди, цинка, свинца, кадмия, мышьяка, ртути, олова, никеля, железа, хрома, селена, кобальта) методами атомной спектрометрии (атомно-абсорбционной спектрометрией с атомизацией в пламени, в графитовой печи и с использованием техники генерации гидридов, атомно-эмиссионной спектрометрией с индуктивно-связанной плазмой) и инверсионно-вольтамперометрическим методом. Исследования по безопасности пищевых продуктов проводятся в соответствии с СанПиН 2.3.2.1078-01 «Гигиенические требования к безопасности и пищевой ценности пищевых продуктов».
2.3.1. Автоклавная минерализация
Пробоподготовка рыбы проводилась на автоклавном комплексе МКП–04
2.3.1.1. Подготовка проб рыбы к анализу
Отбор и подготовку проб пищевых продуктов и сырья к испытанию проводят в соответствии с нормативной документацией на исследуемый вид продукции.
В связи с использованием для разложения малых навесок образца (1–4 г) особое внимание следует уделить обеспечению представительности навески.
При сложном составе проб, представляющих смесь белков, углеводов, клетчатки, жиров, особенно при их неравномерном распределении в пробе (мясные, рыбные консервы, кондитерские изделия и т.д.), пробу перед анализом усредняют путем ее тщательного измельчения (гомогенизации) и перемешивания.
|
|
|
Масса навески пробы для минерализации не должна превышать величину, рекомендованную для данного вида продукции.
Залитые реактивами навески образца выдерживают при комнатной температуре в течение 30-40 минут.
При подготовке лабораторной пробы не допускается использование инструментов и оборудования, загрязняющих пробу определяемыми элементами.
2.3.1.2.Автоклавный метод минерализации
Метод основан на полной минерализации пробы смесью азотной кислоты и пероксида водорода в герметично замкнутом объеме аналитического автоклава при воздействии повышенной температуры и давления.
Навеску пробы помещают в реакционную емкость, добавляют смесь реактивов и, если необходимо, выдерживают при комнатной температуре.
Для контрольного («холостого») определения в реакционную емкость помещают только смесь реактивов без добавления испытуемой пробы.
Реакционную емкость закрывают крышкой и герметизируют в металлическом корпусе автоклава.
Сборку (герметизацию) автоклава (рис.1) осуществляют в следующем порядке:
• в реакционную емкость 1 загружают пробу исследуемого образца и реактивы, накрывают крышкой 2;
• в корпус 3 вставляют донышко 4 и помещают загруженную реакционную камеру, на крышку реакционной камеры устанавливают тарелку 9; в которую вкладывают пружину 10; выкручивают шток 8 так, чтобы торец штока 8 и ползуна 6 были в одной плоскости внутри крышки 5;
• крышку 5 без усилия надевают на корпус 3 и поворачивают вокруг оси по часовой стрелке до упора в штифт 11, при этом байонетные выступы на корпусе 3 должны полностью совпасть с байонетом крышки 5. Вворачивают шток 8 вручную до касания нижнего торца штока 8 с пружиной 10;
• устанавливают автоклав в приспособление для сборки-разборки, фиксируя его от осевого вращения;
• ключом поворачивают шток 8 по часовой стрелке до упора, при этом происходит взвод пружины и герметизация реакционной камеры.
|
|
|
Автоклав загерметизирован и готов к установке в термостат.
Автоклав помещают в холодный термостат, устанавливают на пульте управления температуру первой стадии нагрева и нагревают автоклавы в соответствии с температурной программой, выдерживая на каждой стадии ступенчатого нагрева в течение времени, указанного в таблице 2.2.
Примечание. Указанное в таблице время выдерживания на первой стадии нагрева не включает в себя время выхода на стационарный режим, а отсчитывается с момента достижения заданной температуры, о чем свидетельствует установка стрелки индикатора на нулевую отметку.
 |
По окончании минерализации с помощью приспособления для переноса извлекают автоклавы из термостата, помещают в устройство для охлаждения и охлаждают до комнатной температуры (30—60 мин в зависимости от типа образца и величины навески).
Рис. 1. Автоклав аналитический.
1 - реакционная емкость, 2 - крышка реакционной емкости, 3 - корпус, 4 - донышко, 5 - крышка корпуса, 6 - ползун, 7 - срезной винт, 8 - шток, 9 - тарелка, 10 - пружина, 11 - штифт.
Разборку (разгерметизацию) автоклава осуществляют в соответствии с правилами, изложенными в техпаспорте.
Разгерметизацию автоклава и последующие операции по подготовке минерализата к анализу проводят в вытяжном шкафу в резиновых перчатках во избежание попадания паров азотной кислоты на кожу рук.
Извлекают реакционную камеру, открывают крышку, раствор количественно переносят в кварцевую или фарфоровую чашку, обмывая внутреннюю полость и крышку автоклава небольшими порциями (2–3 см3) бидистиллированной воды.
Если указанная в таблице 2.2 навеска образца недостаточна для получения необходимой чувствительности определения аналита, возможно объединение растворов-минерализатов из двух реакционных емкостей с навесками одной и той же пробы в одну чашку. Объединенный минерализат подготавливают для анализа, как указано в методике; при расчете результата анализа навески суммируют. При этом контрольный («холостой») опыт проводят в тех же условиях.
2.3.2. Подготовка минерализата к определению токсичных элементов
|
|
|
Подготовку полученного в результате автоклавного разложения минерализата к анализу проводят в соответствии с требованиями методики анализа.
2.3.2.1. Подготовка минерализата к анализу с использованием электрохимических методов
При определении токсичных элементов электрохимическими методами (полярография, инверсионная вольтамперометрия) большое значение для получения правильных результатов играет полнота разложения органических соединений образца. В ряде случаев при использовании указанных в таблице температурно-временных параметров не удается обеспечить полное разложение органических соединений, о чем свидетельствует желтая окраска минерализата различной интенсивности, в зависимости от количества оставшейся в растворе органики. В этом случае необходимо провести ее доокисление как указано ниже.
Полученный минерализат упаривают на водяной бане досуха. Если сухой остаток имеет желтый или коричневый цвет, его обрабатывают небольшим количеством азотной кислоты (0,3– 0,5 см3) и несколькими каплями пероксида водорода и снова нагревают на водяной бане досуха. Если сухой остаток снова окрашен, обработку повторяют до полного удаления органических соединений и получения белого остатка. Полученный остаток переводят в раствор в соответствии с требованиями методики анализа.
2.3.2.2. Подготовка минерализата к анализу с использованием методов атомной спектрометрии
Подготовку минерализата для определения токсичных элементов методами атомной спектрометрии (атомно-абсорбционной спектрометрии, пламенной фотометрии, атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой) проводят в соответствии с требованиями методики анализа.
2.3.3. Подготовка автоклавов к анализу
2.3.3.1. Подготовка к работе металлического кожуха автоклава
После удаления реакционной камеры с минерализатом детали металлического кожуха автоклава промывают горячей проточной водой с мылом (винты не выворачивать!) и просушивают.
2.3.3.2. Подготовка новой реакционной камеры к работе
|
|
|
2.3.3.2.1. Новую фторопластовую реакционную камеру (крышку, реакционную емкость) моют горячей проточной водой с мылом, ополаскивают детали камеры дистиллированной водой.
2.3.3.2.2. Дважды обрабатывают реакционную камеру азотной кислотой в автоклавном режиме: в реакционную емкость заливают 40 см3 азотной кислоты, закрывают крышкой, герметизируют в металлическом кожухе, помещают в термостат, нагревают при 160 °С в течение 4 ч. После охлаждения извлекают камеру из кожуха, сливают азотную кислоту и ополаскивают детали камеры бидистиллированной водой.
2.3.3.2.3. Загружают реакционную камеру реактивами в соответствии с конкретной методикой анализа, проводят нагрев автоклава в соответствии с температурной программой, указанной в таблице. Полученный минерализат контрольного опыта анализируют на содержание определяемого элемента.
Примечание. Для контроля чистоты реакционной камеры необходимо сравнить минерализат, проведенный через процедуру автоклавирования, с контрольным («холостым») раствором, приученным добавлением всех реактивов, но без автоклавирования для учета содержания определяемого элемента в реактивах.
2.3.3.2.4. Повторяют проверку минерализата до отсутствия обнаруживаемой концентрации определяемых элементов в контрольном опыте.
2.3.3.2.5. Хранят реакционную камеру в собранном виде, заполненную бидистиллированной водой.
2.3.3.3. Подготовка реакционной камеры к проведению анализа
2.3.3.3.1. Не рекомендуется оставлять минерализат в реакционной камере после разложения на длительное время.
2.3.3.3.2. После удаления минерализата реакционную камеру ополаскивают бидистиллированной водой, заливают в нее 6–10 см3 концентрированной азотной кислоты и после герметизации автоклав помещают в термостат. Устанавливают температуру 180–200 °С и выдерживают при этой температуре 40–60 мин. После охлаждения автоклава сливают азотную кислоту, ополаскивают детали камеры бидистиллированной водой.
2.3.3.3.3. Хранят реакционную камеру в собранном виде, заполненную бидистиллированной водой.
2.3.4. Требования безопасности
2.3.4.1. Все операции с автоклавом, связанные с использованием исследуемых веществ и химических реактивов, выполняют только в вытяжном шкафу при включенной вытяжной вентиляции в условиях, исключающих попадание химических веществ на обслуживающий персонал или в атмосферу помещения в концентрациях, превышающих нормы, установленные ГН 2.2.4.686–98 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны».
2.3.4.2. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 «Пожарная безопасность. Общие требования» и иметь средства пожаротушения по ГОСТ 12.4.009 – 83 «Пожарная техника для зашиты объектов. Основные виды. Размещение и обслуживание».
2.3.4.3. При работе с автоклавом не допускается:
• эксплуатировать автоклав при обнаружении следов механических повреждений деталей: деформации, трещин, задиров и т. п.;
• использовать в автоклаве реакционные камеры с полностью выработанной линией уплотнения; использовать для разложения химические вещества и реактивы, не указанные в методике анализа, в частности хлорную кислоту;
• использовать массы навесок проб и объемы реагентов больше указанных в таблице;
• использовать перегрев автоклава выше рабочей температуры, указанной в методике анализа, для форсирования процесса разложения исследуемых веществ;
• открывать автоклав, не охладив его до комнатной температуры в устройстве для охлаждения автоклавов;
• опускать автоклавы в термостат, температура которого превышает комнатную температуру;
• продолжать разложение пробы после срабатывания предохранительного клапана; при этом клапан будет расположен выше верхней плоскости крышки металлического кожуха автоклава, а момент срабатывания может сопровождаться характерным хлопком.
Примечание. В случае срабатывания предохранительного клапана в любом из автоклавов следует прекратить дальнейшую тепловую обработку автоклавов в термостате:
• выключить прибор регулирования температуры (отжать кнопки НАГРЕВ и СЕТЬ), вынуть вилку сетевого кабеля прибора регулирования из розетки электропитания;
• снять с термостата защитную крышку;
• извлечь автоклав, у которого сработал предохранительный клапан, и остальные автоклавы с помощью сервисного приспособления для переноса и охладить их до комнатной температуры в охлаждающем устройстве;
• автоклав, у которого сработал предохранительный клапан, разобрать, все детали промыть водой с мылом и протереть насухо. Для сокращения времени контакта кожуха автоклава с кислотой эти операции должны выполняться как можно быстрее.
После остывания термостата до комнатной температуры следует:
• промыть внутреннюю поверхность защитной крышки водой с мылом и протереть насухо;
• протереть влажной тряпкой крышку корпуса термостата и ячейки для автоклавов, вытереть насухо.
2.3.4.4. Перед началом работы с комплексом следует убедиться в отсутствии повреждения изоляции питающих кабелей.
2.3.4.5. При проведении профилактических работ и технического обслуживания необходимо отключить комплекс от сети.
2.3.4.6. Для подключения комплекса необходимо использовать розетки, имеющие заземляющие контакты, которые должны быть подсоединены к заземляющему контуру.
Таблица 2.2
Условия минерализации проб рыбы в автоклаве НПВФ «АНКОН–АТ–2» с реакционной камерой, вместимостью 150 см3
| Наименование объекта | Масса навески, г | Объем реактивов, см3 | Экспозиция (комнатная температура) | Температура и время нагрева, ч | Примечание |
| Рыба живая, охлажденная, мороженная | 3,00 | HNO3-6 Н2О2- 1 | 30—40 мин | 160°С - 1 ч 180°С – 2 ч 200°С - 1 ч | Для жирных сортов – заливают на ночь HNО3, утром добавляют Н2О2 |
ГЛАВА III. СОДЕРЖАНИЕ ТОКСИЧНЫХ ЭЛЕМЕНТОВ В РЫБЕ ПОВЕРХНОСТНЫХ ВОДОТОКОВ БИРОБИДЖАНСКОГО РАЙОНА ЕАО
Значения концентраций металлов в пробах сравнивали с принятыми в России допустимыми остаточными концентрациями (ДОК) этих элементов в свежих рыбопродуктах. Они описаны в санитарных правилах и нормах (СанПиН) 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
Допустимые уровни данных элементов для рыбы:
Pb - 1 мг/кг; Cd - 0,2 мг/кг; Hg: - Нехищные - 0,3 мг/кг, - Хищники - 0,6 мг/кг,
- Морские - 0,5 мг/кг; As - 1 мг/кг.
В результате данной работы было проанализировано 17 проб рыбы, что составляет 68 элемент-определения. Подготовка одной пробы рыбы занимает примерно 20 мин. Разложение рыбы в автоклаве занимает 4 ч. Анализ 6 проб рыбы атомно-абсорбционным методом по одному металлу занимает примерно 1 ч.
По содержанию в 2010 году в организме промысловых рыб токсичные элементы располагаются в следующие ранжированные ряды (токсичные элементы, имеющие концентрацию меньше предела обнаружения, не сравнивались между собой):
Хариус амурский – Hg > As, Cd, Pb Карась серебряный – Hg > As, Pb, Cd Ленок – Hg > As, Pb, Cd Щука – Hg > Pb > As, Cd Змееголов – Hg > Cd > As, Pb Ленок (пятнистый) – Hg > Cd > Pb > As
Распределение металлов по уменьшению величин их концентрации по организму специфично для каждой пробы рыб, однако имеются некоторые общие черты. В целом в организме рыб реки Урми и Ин преобладает ртуть. Мышьяк, свинец и кадмий, по допустимым остаточным концентрациям этих элементов в свежемороженых рыбопродуктах, находятся, либо в минимальных концентрациях, либо в концентрациях ниже предела обнаружения.
Изменение концентраций по разным токсичным элементам в речной рыбе поверхностных водотоков Биробиджанского района ЕАО, можно наблюдать на рис. 2, 3, 4.

Рис. 2. Содержание свинца в рыбе, октябрь – декабрь 2010г.
Содержание свинца в речной рыбе поверхностных водотоков Биробиджанского района ЕАО не превышает допустимую остаточную концентрацию. В щуке концентрация свинца равна 0,24% от ДОК.
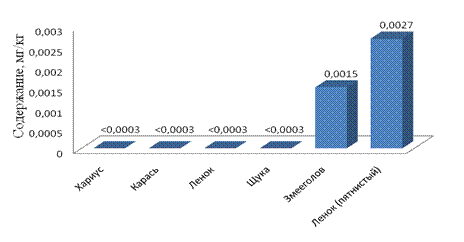
Рис. 3. Содержание кадмия в рыбе, октябрь – декабрь 2010г.
Содержание кадмия в речной рыбе поверхностных водотоков Биробиджанского района ЕАО также не превышает допустимую остаточную концентрацию. Максимальная концентрация кадмия в пробах речной рыбы наблюдается в ленке (пятнистый) и она составляет 1,35% от ДОК.
Низкая концентрация мышьяка, свинца и кадмия в промысловой рыбе поверхностных водотоков Биробиджанского района ЕАО может быть связана, как с природными особенностями районов, так и с физиологическими процессами (дыхание, кроветворение, накопление жировой прослойки, выделение и др.). А неодинаковое накопление токсичных элементов между разными видами рыб может быть обусловлено различными районами вылова рыб, особенностями предпочтения различными видами рыб находится в чистой или загрязненной зоне, возрастом рыбы и характером питания. Это хорошо видно на рис. 2, 3, 4.
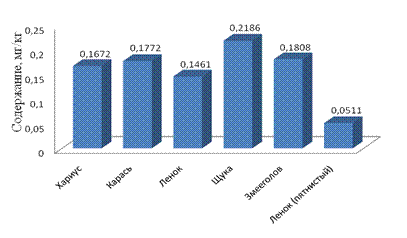
Рис. 4. Содержание ртути в рыбе, октябрь – декабрь 2010г.
Содержание ртути в речной рыбе поверхностных водотоков Биробиджанского района ЕАО хоть и не превышает допустимую остаточную концентрацию, но по сравнению с другими элементами имеет характерную выраженность, как в концентрации, так и в колебаниях между видами рыб. Поступление ртути в организм речной рыбы может быть связан с природными особенностями ЕАО (залеганием минералов-концентратов, к числу которых относят сфалерит). Заметное превалирование ртути над мышьяком, свинцом и кадмием в организме рыб связано с высоким сродством ртути с белком, которая накапливается преимущественно в мышечной ткани (Лукьяненко, 1983; Петухов, Морозов, 1983; Богдановский, 1994). Этот металл является чрезвычайно опасным для жизнедеятельности гидробионтов. Он накапливается в разных звеньях трофических цепей за счет способности живых организмов аккумулировать этот металл до концентраций, в сотни и тысячи раз превосходящих его содержание в окружающей среде. Содержание ртути в пище и окружающих средах определяет его уровень в гидробионтах. Так, характер питания беспозвоночных практически не влияет на содержание ртути в их теле, и лишь хищные гидробионты, находящиеся в конце пищевой цепи, накапливают более высокие концентрации ртути (Никаноров, Жулидов, 1991).
Содержание мышьяка в речной рыбе поверхностных водотоков Биробиджанского района ЕАО ниже предела обнаружения.
Таким образом, для рыб щука, карась, обитающих в р. Ин, характерно наличие в тканях и органах Pb и Hg, а для рыб змееголов, ленок, обитающих в р. Урми, – кадмия.
По содержанию в организме промысловых рыб токсичные элементы располагаются в следующие ранжированные ряды (токсичные элементы, имеющие концентрацию меньше предела обнаружения, не сравнивались между собой):
Хариус амурский – Hg > Cd > As > Pb Ленок – Hg > Pb > Cd > As Змееголов – Hg > Cd > As, Pb Карась серебряный – Hg > Cd > As > Pb Хариус амурский – Hg > Cd > As, Pb Ленок – Hg > As > Cd > Pb
Расположение токсичных элементов, в ранжированных рядах, по сравнению с результатами исследований речной рыбы в 2010 году практически не изменились. Так же наблюдается преобладание ртути над другими элементами. Небольшое изменение в содержании мышьяка, свинца и кадмия. В некоторых образцах они поднялись до уровня обнаружения данным методом, но также не превышают допустимые уровни.
Рассмотрим токсичные элементы в речной рыбе в сравнении с 2010 г. Изменение концентраций по разным токсичным элементам в речной рыбе поверхностных водотоков Биробиджанского района ЕАО по сравнению с 2010 годом, можно наблюдать на рис. 5, 6, 7.

Рис. 5. Содержание мышьяка в рыбе, 2010 – 2012 гг.
Содержание мышьяка в речной рыбе 2012 года по сравнению с 2010 возросло до уровня обнаружения её в пробах. Но в некоторых пробах рыбы, концентрация мышьяка остается также ниже предела обнаружения, в сравнении с 2010 г. Максимальная концентрация мышьяка наблюдается в пробах ленка (0,0226 мг/кг) за 2012 год, она составляет 2,26% от допустимого уровня мышьяка в речной рыбе (ПДКAs – 1 мг/кг).
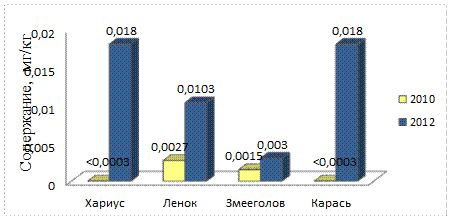
Рис. 6. Содержание кадмия в рыбе, 2010 – 2012 гг.
Содержание кадмия в речной рыбе поверхностных водотоков Биробиджанского района ЕАО по сравнению с 2010 годом возросло. Самые большие концентрации наблюдаются у хариуса (0,018 мг/кг) и серебряного карася (0,018 мг/кг), что составляет 9% от ДОК.

Рис. 7. Содержание ртути в рыбе, 2010 – 2012 гг.
Содержание ртути в речной рыбе поверхностных водотоков Биробиджанского района ЕАО сильно не изменились. Однако наблюдается небольшое уменьшение ртути в хариусе, ленке, серебряном карасе и небольшое увеличение у змееголова. В среднем концентрация ртути в хариусе, ленке и серебряном карасе за 2012 год уменьшилось в 1,5 – 2 раза по сравнению с показателями за 2010г.
Содержание свинца в речной рыбе поверхностных водотоков Биробиджанского района ЕАО практически во всех пробах ниже предела обнаружения. Но небольшая концентрация свинца наблюдается у одной из проб ленка, также как и в 2010г. В 2010 она составляла 0,0012 мг/кг, а в 2012 она составила 0,036 мг/кг. Что в 30 раз превышает концентрацию свинца в пробе ленка за 2010г.
Таким образом, содержание мышьяка, кадмия и свинца в речной рыбе поверхностных водотоков Биробиджанского района ЕАО по сравнению с 2010 годом возросло, но также не превышает предельно допустимые концентрации токсичных элементов. Сильных изменений в содержании ртути не обнаружено.
Было установлено, что максимальная концентрация токсичных элементов в речной рыбе поверхностных водотоков Биробиджанского района ЕАО за 2010 – 2012 гг. в отобранных пробах составила:
· свинец – 0,036 мг/кг (ПДК – 1 мг/кг);
· кадмий – 0,018 мг/кг (ПДК – 0,2 мг/кг);
· ртуть – 0,2369 мг/кг (ПДК – от 0,3 до 0,6 мг/кг);
· мышьяк – 0,0226 мг/кг (ПДК – 1 мг/кг),
что не превышает допустимую остаточную концентрацию по данным элементам.
По содержанию в организме промысловых рыб токсичные элементы располагаются в следующие ранжированные ряды (токсичные элементы, имеющие концентрацию меньше предела обнаружения, не сравнивались между собой).
Рассмотрим токсичные элементы в речной рыбе в сравнении с 2010- 2015 гг. Изменение концентраций по разным токсичным элементам в речной рыбе поверхностных водотоков Биробиджанского района ЕАО по сравнению с 2010-2012 годом, можно наблюдать на рис. 8, 9, 10.
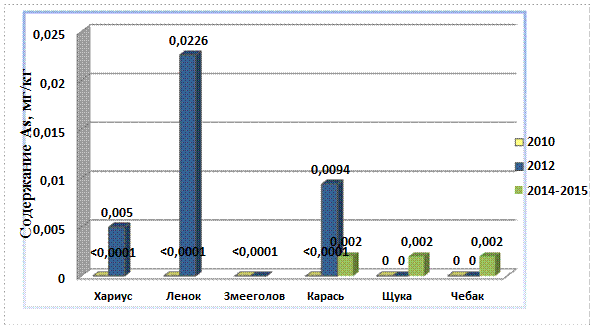
Рис. 8. Содержание мышьяка в рыбе, 2010 – 2015 гг.
Содержание мышьяка в речной рыбе 2015 года по сравнению с 2010 стало ниже уровня обнаружения её в пробах. Максимальная концентрация мышьяка наблюдается в пробах ленка (0,0226 мг/кг) за 2012 год, она составляет 2,26% от допустимого уровня мышьяка в речной рыбе (ПДК As – 1 мг/кг).
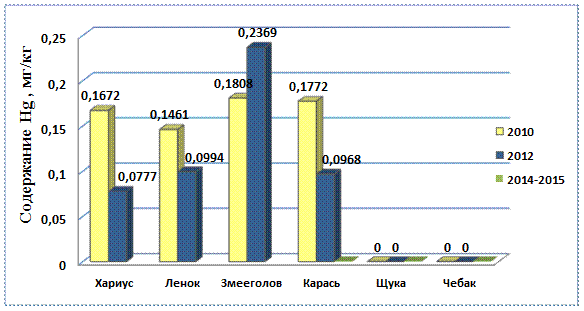
Рис. 9. Содержание ртути в рыбе, 2010 – 2015 гг.
Содержание ртути в речной рыбе поверхностных водотоков Биробиджанского района ЕАО стало значительно меньше, концентрация которой выявленная на 2015 год составляет менее 0,0005мг/кг
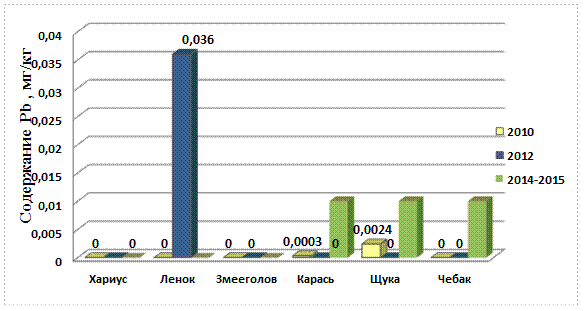
Рис. 10. Содержание свинца в рыбе 2010-2015 гг.
Содержание свинца в речной рыбе поверхностных водотоков Биробиджанского района ЕАО практически во всех пробах ниже предела обнаружения. Но небольшая концентрация свинца наблюдается у одной из проб ленка, также как и в 2010г. В 2010 она составляла 0,0012 мг/кг, а в 2012 она составила 0,036 мг/кг. Что в 30 раз превышает концентрацию свинца в пробе ленка за 2010г. В 2015 г. содержание составляет менее 0,01. Что говорит об уменьшении концентрации по сравнению с 2012 годом.
Таким образом, содержание мышьяка, кадмия и свинца в речной рыбе поверхностных водотоков Биробиджанского района ЕАО по сравнению с 2010 годом уменьшилось и не превышает предельно допустимые концентрации токсичных элементов. Сильных изменений в содержании ртути не обнаружено.
В результате данной работы было выявлено, что речная рыба поверхностных водотоков Биробиджанского района ЕАО по концентрации свинца, кадмия, мышьяка и ртути не превышают допустимые остаточные концентрации (ДОК) этих элементов в свежих рыбопродуктах, по санитарным правилам и нормам, описанных в (СанПиН) 2.3.2.1078-01 «Гигиенические требования к безопасности и пищевой ценности пищевых продуктов». Вследствие этого можно говорить, что речная рыба поверхностных водотоков Биробиджанского района ЕАО пригодна к употреблению в пищу.
ВЫВОДЫ
1. Подготовлен информационно-аналитический обзор по теме «Содержание токсичных элементов в рыбе поверхностных водотоках ЕАО».
2. Установлено, что максимальная концентрация токсичных элементов в речной рыбе поверхностных водотоков Биробиджанского района ЕАО за 2010 – 2015 гг. в отобранных пробах составила: свинец – 0,036 мг/кг (ПДК – 1 мг/кг); кадмий – 0,018 мг/кг (ПДК – 0,2 мг/кг); ртуть – 0,2369 мг/кг (ПДК – от 0,3 до 0,6 мг/кг); мышьяк – 0,0226 мг/кг (ПДК – 1 мг/кг), что не превышает допустимую остаточную концентрацию по данным элементам.
· Содержание мышьяка в речной рыбе 2012 года по сравнению с 2010 возросло до уровня обнаружения её в пробах. Но в некоторых пробах рыбы, концентрация мышьяка остается также ниже предела обнаружения, в сравнении с 2010 г. Максимальная концентрация мышьяка наблюдается в пробах ленка (0,0226 мг/кг) за 2012 год, она составляет 2,26% от допустимого уровня мышьяка в речной рыбе (ПДКAs – 1 мг/кг).
· Содержание кадмия в речной рыбе поверхностных водотоков Биробиджанского района ЕАО по сравнению с 2010 годом возросло. Самые большие концентрации наблюдаются у хариуса (0,018 мг/кг) и серебряного карася (0,018 мг/кг), что составляет 9% от ДОК.
· Содержание ртути в речной рыбе поверхностных водотоков Биробиджанского района ЕАО сильно не изменились. Однако наблюдается небольшое уменьшение ртути в хариусе, ленке, серебряном карасе и небольшое увеличение у змееголова. В среднем концентрация ртути в хариусе, ленке и серебряном карасе за 2012 год уменьшилось в 1,5 – 2 раза по сравнению с показателями за 2010г.
· Содержание свинца в речной рыбе поверхностных водотоков Биробиджанского района ЕАО практически во всех пробах ниже предела обнаружения. Но небольшая концентрация свинца наблюдается у одной из проб ленка, также как и в 2010г. В 2010 она составляла 0,0012 мг/кг, а в 2012 она составила 0,036 мг/кг. Что в 30 раз превышает концентрацию свинца в пробе ленка за 2010г.
Таким образом, содержание мышьяка, кадмия и свинца в речной рыбе поверхностных водотоков Биробиджанского района ЕАО по сравнению с 2010 годом возросло, но также не превышает предельно допустимые концентрации токсичных элементов. Сильных изменений в содержании ртути не обнаружено.
4) В результате данной работы было выявлено, что речная рыба поверхностных водотоков Биробиджанского района ЕАО по концентрации свинца, кадмия, мышьяка и ртути не превышают допустимые остаточные концентрации (ДОК) этих элементов в свежих рыбопродуктах, по санитарным правилам и нормам, описанных в (СанПиН) 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов». Вследствие этого можно говорить, что речная рыба поверхностных водотоков Биробиджанского района ЕАО пригодна к употреблению в пищу.
СПИСОК ЛИТЕРАТУРЫ
1) Берг Л.С. Рыбы пресных вод СССР. М.: Наука, 1948. 466 с.
2) Беспамятнов Г.П., Кротов Ю.А. Предельно допустимые концентрации химических веществ в окружающей среде. Справочник. Л.: Химия, 1985. 675 с.
3) Богдановский Г.А. Химическая экология: учебное пособие. М.: МГУ, 1994. 237 с.
4) Большая советская энциклопедия: В 30 т. М.: "Советская энциклопедия", 1969-1978.
5) Будников Г.К. Тяжелые металлы в экологическом мониторинге водных систем. Соросовский образовательный журнал. № 5 1998. 23-29 с.6) Васильева Е.Д. Рыбы. М.: Астрель, 1999. 640 с.7) Весёлов Е.А. Определитель пресноводных рыб. М.: Просвещение, 1997. 238 с.
8) ГН 2.2.4.686–98 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны».
9) ГОСТ 12.1.004-91 «Пожарная безопасность. Общие требования».
10) ГОСТ 12.4.009 – 83 «Пожарная техника для зашиты объектов. Основные виды. Размещение и обслуживание».
11) ГОСТ 26929–94 «Сырье и продукты пищевые. Подготовка проб. Минерализация для определения содержания токсичных элементов».
12) Даффус Дж.Х. «Тяжелые металлы». Vol. 74, № 5, 2002. 793-807 с.
13) Доклад об экологической ситуации в Еврейской автономной области в 2011 году. Биробиджан: УПР по ЕАО, 2011. 46 с.
14) Евтушенко Н.Ю., Сытник Ю.М., Шаповал Т.Н., Кукля И.Г. Тяжелые металлы в рыбах среднего Дуная // Водные ресурсы. Т. 20. № 5. 1993. 605-614 с.
15) Ершов Ю.А., Попков В.А., Берлянд А.С., Книжник А.З. Кадмий экологические аспекты. М.: Медицина, 1994. 165 с.
16) Жуков П.И. Справочник по экологии пресноводных рыб. М.: Наука и техника, 1988. 208-214 с.
17) Зайцева И.И. Экспериментальное изучение влияния тяжелых металлов на планктонные водоросли // Ботанический журнал. №8, 1999. 33-39 с.
18) Ильин В.Б. Микроэлементы и тяжёлые металлы в почвах и растениях Новосибирской области. Н.: СО РАН, 2001. 229 с.
19) Кабата-Пендиас А., Пендиас X. Микроэлементы в почвах и растениях. М.: Мир, 1989. 439 с.
20) Кеннет Г., Фальчук И. Нарушения метаболизма микроэлементов // Внутренние болезни. Кн. 2. М.: Медицина, 1993. 451-457 с.
21) Клейменов И.Я. Химический и весовой состав основных промысловых рыб. М., 1952. 58 с.
22) Кнунянц И.Л. Химическая энциклопедия. М.: Советская энциклопедия, 1995. 639 с.
23) Криксунов Е.А. Экологи. М.: Дрофа, 1995. 240 с.
24) Лужников Е.А., Суходолова Г.Н. Острые отравления у взрослых и детей. М.: ЭКСМО, 2009. 556 с.
25) Лукьяненко В.И. Общая ихтиотоксикология. М.: Легкая и пищевая пром-сть, 1983. 320 с.
26) Лэне Т.В., Морель М.М. Биологическая функция для кадмия в морских диатомовых водорослях. 1999. 97 с.
27) Майстренко В.Н., Хамитов Р.З., Будников Г.К. Экологический мониторинг суперэкотоксикантов. М.: Химия, 1996. 320 с.
28) Материалы конференций по анализу природных и сточных вод в России за последние 5-10 лет.
29) Медведев В.Е. Курганы Приамурья. Новосибирск: ИАиЭ СО РАН, 1998. 144 с.
30) Мелихов А. Биробиджан — Земля обетованная. История одной грёзы «Октябрь» № 12, 2006. 16-45 с.31) Миркин Б.М., Наумова Л.Г. Экология России. 1995. 232 с.
32) Миркин Б.М., Наумова Л.Г. Экология России. Учебник из Федерального комплекта для 9 - 11 классов общеобразовательной школы. Изд. 2-е, перераб. И доп. - М.: АО МДС, 1996. 272 с.
33) Мур Дж.В., Рамамурти С. Тяжелые металлы в природных водах. М.: Мир, 1987. 286 с.
34) Никаноров А.М., Жулидов А.В. Биомониторинг металлов в пресноводных экосистемах. Л.: Гидрометеоиздат, 1991. 312 с.
35) Никольский Г.В. Рыбы бассейна Амура. М.: Изд-во АН СССР, 1956. 551 с.
Актуальность работы. Современному развитию российского общества свойственны специфические проблемы, как социально-экономического, так и духовно-нравственного характера. При всем том, если экономические трудности видны и находятся как бы под неусыпным контролем социума, то нравственные, культурные, духовные проблемы не лежат на поверхности, но они глубоки и требуют неотложного решения.
Особенно важными являются противоречия в социально-воспитательном процессе молодого поколения россиян. В связи с чем, создание системы духовно-нравственного воспитания молодежи на основе богатого опыта предшествующих поколений, стержнем которого являются народные традиции, на сегодняшний день весьма актуально. К сожалению, явный перекос в сторону сотворения материальных ценностей и их культа, переоценка роли образования и недооценка роли воспитания в становлении новых поколений россиян, привели к возникновению феномена бездуховности молодежи. Данная ситуация разрушительна для системы традиционных ценностей и традиционного механизма социализации поколений. Обстоятельства говорят о том, что необходимо переосмыслить опыт в сфере духовно-нравственного воспитания молодого поколения россиян, приобщить его к нынешним условиям, возрождая при этом традиции народа.
Каждое общество исторически по-разному и в различных формах приобщало новые поколения к основным социальным ценностям и нормам. Необходимость исследования специфики социализации детей и молодежи в условиях переходного общества, которым в настоящее время является Россия, вызвана изменениями в индивидуальном и массовом сознании, сопровождающими закономерно обусловленную модернизацию экономической, политической системы, а также системы управления социальной структурой общества. За кратчайший, по историческим меркам период времени (с середины 1980-х гг. и до настоящего времени) в России осуществляется смена тоталитарной формы государственного правления на демократическую; политическое и экономическое единообразие уступило место многопартийности, многообразию форм собственности; воинствующий атеизм - свободе вероисповедания; однообразие духовной жизни и творчества, ориентировавшее индивидуальное и массовое сознание, поведение и деятельность индивидов на следование догмам революционного марксизма, - плюрализму; информационная и культурная изолированность от внешнего мира - гласности, открытости, добровольному и равноправному сотрудничеству представителей многочисленных этносов, конфессий, культур и т.д.; идеология революционного мессианства, аскетизма и самопожертвования ради победы мировой коммунистической революции, классовой ненависти к ее реальным и потенциальным врагам, как за пределами своего социума, так и внутри его – признанию приоритета общечеловеческих ценностей, чести и достоинства личности, человеческой индивидуальности, политической, религиозной, этнической толерантности в отношениях между индивидами, социальными группами, государствами [7,с.52].
Степень разработанности проблемы. Особенности становления молодёжи как социальной и возрастной группы рассматриваются в трудах М.Х.Титмы, И.С.Кона, В.Т.Лисовского, Ю.Г.Волкова, В.Ливанова, В.Левичевой, Ф.Шереги, А.Габиани, Л.Волошиной, Я.Гилинского, Э.Раска, А.Яковлева, В.Магу на, В.В.Семеновой и др. Вопросы социально-психологического направления в развитии молодёжной проблематики освещены в работах И.С.Кона, В.Т.Лисовского и др. Проблемам девиантного поведения посвятили свои труды А.Габиани, А.Е.Личко, Г.Я.Лукачер, Н.В.Макшанцева, Т.В.Иванова, В.А.Чудновский, Г.А.Аванесов, Ю.Д.Блувштейн, С.Е.Вицин, Н.Я.Заблоцкис, Г.И.Забрянский, В.В.Панкоратов, Ю.Е.Аврутин, Я.И.Гилинский, А.Лепс, Э.Раска, В.С.Афанасьев, В.Н.Кудрявцев, И.В.Маточкин, Р.С.Могилевский, А.М.Яковлев, А.Б.Шапиро и др.
Теоретическая значимость исследования состоит в том, что материалы и выводы данного исследования могут быть использованы в работе социального педагога; в дальнейших научных исследованиях и разработках по проблемам социализации детей и молодежи.
Цель работы изучить факторы социализации детей и молодежи в современном обществе.
Объектом нашего исследования является социализация детей и молодежи в современном обществе.
Предметом исследования - микро-факторы социализации детей и молодежи в условиях современного общества.
Задачи:
- изучить сущность и особенности социализации детей и молодежи;
- рассмотреть основные подходы к классификации факторов социализации детей и молодежи
- исследование влияния факторов социализации детей и молодежи в современном российском обществе
Структура работы состоит из введения, двух глав, заключения и списка используемой литературы.
Глава 1. Теоретические аспекты изучения факторов социализации детей и молодежи в современном обществе
|
|
|
|
|
Дата добавления: 2015-06-27; Просмотров: 951; Нарушение авторских прав?; Мы поможем в написании вашей работы!