
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Взвешивающие коэффициенты для отдельных видов излучения при расчете эквивалентной дозы. 2 страница
|
|
|
|
Протоны, дейтроны и α-частицы, ускоренные до высоких энергий (200 МэВ и более), имеют примерно такую же ОБЭ, как и рентгеновское стандартное излучение.
При проведении лучевой терапии злокачественных опухолей перед радиологами стоит задача подведения дозы к опухоли, необходимой для уничтожения опухолевых клеток, сохраняя при этом жизнеспособность окружающих нормальных тканей. Для сенсибилизации гипоксических опухолевых клеток радиологи-онкологи применяют во время сеанса облучения кислород, проводят облучение в условиях гипербарической оксигенации (ГБО). Другой путь - гипоксирадиотерапия, вдыхание смесей, содержащих 8-10 % кислорода. При этом радиорезистентность нормальных тканей повышается быстрее и в большей степени, чем уже исходно гипоксических резистентных опухолевых клеток. Усиление гибели опухолевых клеток происходит при терморадиотерапии, при которой производят нагрев опухоли с помощью СВЧдатчиков до температуры 41-43,5 °C и облучение. Считается, что опухоль прогревается больше, чем нормальные ткани, так как из-за неполноценности развития сосудистой сети уменьшен отвод тепла от опухоли и в ней подавляются процессы репарации. Улучшение пространственного распределения дозы происходит при применении тяжелых заряженных частиц - протонов, π-мезонов и тяжелых ионов. Особенностью радиобиологического действия этих тяжелых частиц и нейтронов является ослабление радиозащитного эффекта опухолевой гипоксии.
Получено радиобиологическое обоснование применения режимов фракционирования, отличающихся от классических, например режим мультифракционирования, при котором дробление дневной дозы приводит к снижению тяжести лучевых осложнений.
В 1969 г. F. Ellis предложил формулу, в которой попытался учесть связь биологического эффекта облучения с суммарной дозой, числом фракций, временем лечения. Было введено понятие «НСД» - «номинальная стандартная доза», которая и являлась коэффициентом связи между всеми факторами. Толерантность всех органов и тканей по F. Ellis равноценна толерантности соединительной ткани. Величины толерантных доз были получены на базе многочисленных экспериментальных и клинических данных. В то время было уже хорошо известно об уровне толерантности нормальных тканей
при типичных курсах лучевой терапии, при которых суммарная очаговая доза 60 Гр подводилась к опухоли ежедневными разовыми очаговыми дозами 2 Гр 5 раз в неделю за 6 нед. НСД применима только при курсах лечения постоянной разовой дозой, числом фракций более 4 и длительностью лечения от 10 до 100 дней. Предел толерантности достигается при НСД = 1800. При этих значениях вероятность риска лучевых повреждений здоровых тканей не превышает 5 % при площади облучения 100 см2. Предложенная F. Ellis формула имела следующий вид:
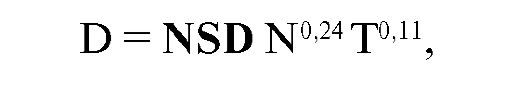
где D - суммарная доза за весь курс лечения, N - число фракций, T - время лечения в днях, NSD (НСД) -номинальная стандартная доза.
При изменении общего времени курса, разовой дозы, числа фракций используют расчеты на основе концепции ВДФ (время - доза - фракционирование), разработанной С. Ортоном и Ф. Эллисом (C. Orton и F. Ellis). При этом рассчитывают дозу, характеризующую степень лучевого поражения ткани, но с учетом поправок на восстановление ткани в перерывах между фракциями, на восстановление клеточной популяции за все время курса лучевой терапии.
Фактор ВДФ (время - доза - фракционирование) - это количественная оценка эффекта облучения по критерию предельной толерантности нормальной соединительной ткани и кожи. С помощью модели ВДФ (время - доза - фракционирование) при планировании лучевой терапии можно решить следующие задачи: сравнить различные режимы фракционирования дозы, определить изоэффективные дозы для различных схем фракционирования, учесть перерывы в облучении. Значения фактора ВДФ позволяют планировать следующие параметры внутриполостного облучения: суммарную поглощенную дозу, время облучения, мощность дозы облучения.
Концепция была создана путем математической интерпретации результатов клинических наблюдений и радиобиологических экспериментов. В конечном счете была создана формула для расчетов, которые сведены в удобные таблицы (см. Приложение). По этим таблицам можно определить фактор ВДФ при разных дозах за фракцию, количество фракций, соответствующих разным дозам за фракцию. Формула расчета фактора ВДФ имеет следующий вид:
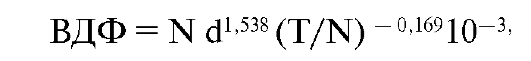
где d - разовая доза облучения здорового органа (сГр),
T - длительность курса лечения (сутки), N - число фракций облучения.
Предельное значение ВДФ составляет 100 единиц.
Критерий ВДФ можно использовать при любых условиях облучения - при расщепленном курсе, при разных методах (дистанционная и контакт-
ная) лучевой терапии. Критерий ВДФ является универсальной величиной, учитывающий дозу на орган, условия фракционирования, условия облучения, длительность курса.
Кумулятивный радиационный эффект (КРЭ) - это количественная оценка постепенного накопления эффекта облучения в нормальной соединительной ткани. Параметр основан на клеточно-кинетической модели и программе расчета относительного числа выживших клеток для любой ткани при разных условиях фракционирования. Величина КРЭ выражается через ВДФ.
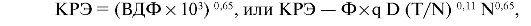
где Ф - поправочный коэффициент для учета объема облучения, q - коэффициент относительной биологической эффективности.
Единицей КРЭ является ерэ - единица радиационного эффекта. Толерантность кожи и соединительной ткани определяется величиной КРЭ = 1800 ерэ, что соответствует величине ВДФ, равной 100. Существуют кривые значений КРЭ в зависимости от числа фракций и разовой дозы при облучении два, три, четыре, пять раз в неделю. С помощью коэффициента снижения Ксн= e-0,003Tп можно учесть снижение КРЭ за счет частичного восстанов-
ления поврежденных тканей, зная время перерыва в лечении Тп.
Использование модели ВДФ, разработанной применительно к универсальной соединительной ткани, сохраняет свое значение, но более широкие возможности имеет линейно-квадратичная модель (LQ-модель). В основе модели лежат представления радиобиологов о том, что поражение ДНК может быть летальным и нелетальным, но нелетальные поражения, например однонитевые разрывы ДНК, могут превратиться в летальные при совпадении однонитевых разрывов в противоположных нитях ДНК, так как они становятся двунитевыми. В соответствии с этими представлениями гибель клеток, обусловленная одномоментными двойными разрывами, то есть летальное поражение клеток, характеризуется функцией, линейно зависящей от дозы излучения, а гибель клеток с возможностью сублетальных повреждений линейно нарастает с квадратом дозы. Эти процессы отражены в модели параметрами α и β. Значения этих параметров определяются по кривым выживаемости стволовых клеток. Определить величину этих параметров отдельно для клеток в составе ткани невозможно, но возможна оценка отношения α/β при равноэффективных режимах. Отношение α/β измеряется в Гр и численно соответствует дозе, при которой линейная функция, характеризующая гибель клеток αd), эквивалентна квадратичной βd2).
На основе этой модели, учитывающей клеточную выживаемость, Н. D. Тhames и J. H. Неndгу в 1987 г. предложили метод (формулу) для практического использования, названный ими Fгасtionation-dosage factor - ФДФ (фактор-доза=фракционирование). Оценка эффекта при контактном облучении источниками высокой активности производится по формуле для дистанционного облучения, а при использовании источников низкой активности авторами вводится коэффициент непрерывного восстановления g,
зависящий от времени облучения и времени полувосстановления клеток от сублетальных повреждений. Для режима мультифракционирования, когда времени между двумя дневными фракциями недостаточно для полного восстановления клеток от сублетальных повреждений, авторы формулы также вводят для первой дозы коэффициент неполного восстановления hm, зависящий от времени между дневными сеансами и времени полувосстановления. Таблицы значений отношения α/β, hm и g приведены в книге авторов метода.
Уравнение, которое определяет фракцию клеток, выживших после облучения, имеет вид:
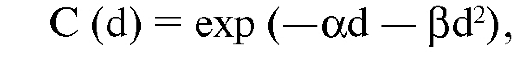
где d - поглощенная доза,
α - параметр модели, характеризующий значимость летального поражения ДНК (линейная функция дозы),
β - параметр модели, характеризующий сублетальное повреждение (квадратичная функция дозы).
После некоторых преобразований эффект от дистанционной фракционированной лучевой терапии можно выразить уравнением:
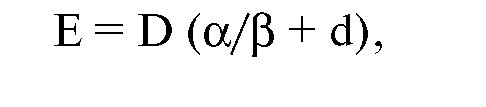
где D - суммарная доза.
Суммарная доза была названа авторами метода дозовым фактором, а (α/β + d) - фактором фракционирования.
С помощью линейно-квадратичной модели оказалось возможным выявить различия в соотношениях доза-время для быстро и медленно или непролиферирующих тканей. В первом случае рано реагирующие на облучение ткани, а также большинство злокачественных опухолей имеют значение коэффициента α/β, равное 7-20 Гр, а поздно реагирующие ткани - 1-6 Гр.
Разными авторами было предложено несколько формул для расчетов с учетом поправки на неполную репарацию, были введены параметры фактора времени для конкретной ткани. В нашей стране на основе линейноквадратичной модели созданы доступные для практической работы таблицы биологически изоэффективных доз относительно стандартного фракционирования по критерию возникновения поздних лучевых повреждений различных тканей (см. Приложение). Таким образом, результаты научных исследований в области экспериментальной и клинической радиобиологии позволяют планировать дозы и число фракций, при которых не будет превышен уровень толерантности нормальных тканей, применять различные режимы фракционирования, а также использовать радиомодификаторы для усиления поражающего действия ионизирующего излучения на опухолевые клетки и защиты окружающих здоровых органов и тканей. Большой вклад в развитие радиобиологических предпосылок лучевой терапии внес отечественный ученый, профессор С. П. Ярмоненко (рис. 19).

Рис. 19. Самуил Петрович Ярмоненко, профессор, доктор биологических наук, лауреат Государственной премии СССР
Радиобиологические основы лу чевой терапии неопухолевых забо леваний. Механизмы локального терапевтического действия так на зываемых малых доз радиации еще недостаточно изучены, несмотря на более чем столетний опыт лучевой терапии неопухолевых заболеваний Сначала эмпирическим путем были выявлены местные эффекты - вы раженный противовоспалительный противоотечный, обезболивающий десенсибилизующий. Эти эффекты приводили к местному улучшению трофики тканей и ликвидации раз личных видов патологических из менений. Отсутствие в начале XX в современной антибактериальной терапии и получение явных положи тельных эффектов при облучении привели к широкому применению лучевой терапии в лечении неопухолевых заболеваний. Среди множества
экспериментальных и клинических исследований того времени выделяются работы М. И. Неменова с сотрудниками. Наряду с местными эффектами ими изучалось действие рентгеновских лучей на нервную систему, в результате чего была создана нейрорегуляторная теория. Согласно этой теории, главным фактором лучевого воздействия является действие на вегетативную нервную систему, гипофизарно-гипоталамическую область, надпочечники. Эта теория служила обоснованием так называемой функциональной лучевой терапии неопухолевых заболеваний.
В те же годы начала развиваться клеточно-ферментативная теория, в которой главным фактором местного лучевого действия является разрушение клеток, прежде всего лейкоцитов, после чего клеточные продукты распада, включая протеолитические ферменты, оказывают положительное влияние на местные тканевые процессы.
Электрохимическая теория исходит из того, что сразу после лучевого воздействия наступает кратковременное усиление ацидоза, который через 6- 24 ч сменяется медленно нарастающим и длительно (8-16 дней) держащимся алкалозом. При этом длительный местный алкалоз способствует угнетению воспаления, устраняет боль, регулирует клеточную проницаемость.
Согласно другой теории - теории ингибирования различных процессов под влиянием облучения, ингибирование порождает вторичную стимуляцию местных процессов и приводит к противовоспалительному, антиспастическому, антисекреторному, десенсибилизирующему и другим местным эффектам радиации.
В настоящее время считается, что лечебные дозы вызывают изменение проницаемости капилляров, усиление дренирования очага воспаления путем улучшения венозного и лимфооттока, уменьшение отека. Все это приводит к последующему стиханию болей, улучшению кровотока и местных трофических процессов. Кроме того, доказано непосредственное воздействие облучения на нервные окончания с изменением функционального состояния нервных центров и узлов в сторону снятия их патологического возбуждения. По-видимому, это приводит к обезболивающему эффекту и улучшению проводимости по нервам.
Накопленные знания об отдаленных эффектах облучения, а также появление других эффективных методов лечения сузили показания к лучевой терапии неопухолевых заболеваний, однако продолжается эффективное лечение больных в тех случаях, когда не помогают другие виды лечения, а также в ситуациях, когда облучение имеет заведомые преимущества.
С учетом нейроэндокринной теории обосновывается применение наряду с облучением области патологических изменений так называемого непрямого облучения - облучения цепочек симпатических узлов, пограничных стволов. Такое облучение улучшает нервно-мышечную проводимость при постампутационном синдроме, фантомных болях, сирингомиелии. Функциональное подавление секреции позволяет использовать этот радиационный эффект, например для временного снижения функции слюнной железы при проведении облучения по поводу невирусного паротита, а также для снижения продукции цереброспинальной жидкости в профилактике отека головного мозга в начале противоопухолевой терапии.
Глава 4. МЕТОДЫ ЛУЧЕВОЙ ТЕРАПИИ
Методы лучевой терапии делятся на наружные и внутренние в зависимости от способа подведения ионизирующего излучения к облучаемому очагу. Сочетание методов называют сочетанной лучевой терапией.
Наружные методы облучения - методы, при которых источник излучения находится вне организма. К наружным методам относятся методы дистанционного облучения на различных установках с использованием разного расстояния от источника излучения до облучаемого очага.
К наружным методам облучения относятся:
- дистанционная γ-терапия;
- дистанционная, или глубокая, рентгенотерапия;
- терапия тормозным излучением высокой энергии;
- терапия быстрыми электронами;
- протонная терапия, нейтронная и терапия другими ускоренными частицами;
- аппликационный метод облучения;
- близкофокусная рентгенотерапия (при лечении злокачественных опухолей кожи).
Дистанционная лучевая терапия может проводиться в статическом и подвижном режимах. При статическом облучении источник излучения неподвижен по отношению к больному. К подвижным методам облучения относятся ротационно-маятниковое или секторное тангенциальное, ротационно-конвергентное и ротационное облучение с управляемой скоростью. Облучение может осуществляться через одно поле или быть многопольным - через два, три и более полей. При этом возможны варианты встречных или перекрестных полей и др. Облучение может проводиться открытым пучком или с использованием различных формирующих устройств - защитных блоков, клиновидных и выравнивающих фильтров, решетчатой диафрагмы.
При аппликационном методе облучения, например в офтальмологической практике, аппликаторы, содержащие радионуклиды, прикладывают к патологическому очагу.
Близкофокусную рентгенотерапию применяют для лечения злокачественных опухолей кожи, при этом расстояние от выносного анода до опухоли составляет несколько сантиметров.
Внутренние методы облучения - методы, при которых источники излучения вводят в ткани или в полости организма, а также применяют в виде радиофармацевтического препарата, введенного внутрь пациента.
К внутренним методам облучения относятся:
- внутриполостное облучение;
- внутритканевое облучение;
- системная радионуклидная терапия.
При проведении брахитерапии источники излучения с помощью специальных устройств вводятся в полые органы методом последовательного введения эндостата и источников излучения (облучение по принципу afterloading). Для осуществления лучевой терапии опухолей разных локализаций существуют различные эндостаты: метрокольпостаты, метрастаты, кольпостаты, проктостаты, стомататы, эзофагостаты, бронхостаты, цитостаты. В эндостаты поступают закрытые источники излучения, радионуклиды, заключенные в оболочку-фильтр, в большинстве случаев имеющие форму цилиндров, игл, коротких стерженьков или шариков.
При радиохирургическом лечении установками гамма-нож, кибер-нож осуществляют прицельное облучение малых мишеней с помощью специальных стереотаксических устройств с использованием точных оптических направляющих систем для трехмерной (three-dimensional - 3D) радиотерапии множественными источниками.
При системной радионуклидной терапии используют радиофармацевтические препараты (РФП), вводимые пациенту внутрь, соединения, тропные к определенной ткани. Например, путем введения радионуклида йода проводят лечение злокачественных опухолей щитовидной железы и метастазов, при введении остеотропных препаратов - лечение метастазов в кости.
Виды лучевого лечения. Различают радикальную, паллиативную и симптоматическую цели лучевой терапии. Радикальную лучевую терапию проводят с целью излечения больного с применением радикальных доз и объемов облучения первичной опухоли и зон лимфогенного метастазирования.
Паллиативное лечение, направленное на продление жизни больного путем уменьшения размеров опухоли и метастазов, выполняют меньшими, чем при радикальной лучевой терапии, дозами и объемами облучения. В процессе проведения паллиативной лучевой терапии у части больных при выраженном положительном эффекте возможно изменение цели с увеличением суммарных доз и объемов облучения до радикальных.
Симптоматическую лучевую терапию проводят с целью снятия какихлибо тягостных симптомов, связанных с развитием опухоли (болевой синдром, признаки сдавления сосудов или органов и др.), для улучшения качества жизни. Объемы облучения и суммарные дозы зависят от эффекта лечения.
Лучевую терапию проводят с различным распределением дозы облучения во времени. В настоящее время применяют:
- однократное облучение;
- фракционированное, или дробное, облучение;
- непрерывное облучение.
Примером однократного облучения служит протонная гипофизэктомия, когда лучевую терапию выполняют за один сеанс. Непрерывное облучение происходит при внутритканевом, внутриполостном и аппликационном методах терапии.
Фракционированное облучение является основным методом подведения дозы при дистанционной терапии. Облучение проводят отдельными порциями, или фракциями. Применяют различные схемы фракционирования дозы:
- обычное (классическое) мелкое фракционирование - 1,8-2,0 Гр в день 5 раз в неделю; СОД (суммарная очаговая доза) - 45-60 Гр в зависимости от гистологического вида опухоли и других факторов;
- среднее фракционирование - 4,0-5,0 Гр в день 3 раза в неделю;
- крупное фракционирование - 8,0-12,0 Гр в день 1-2 раза в неделю;
- интенсивно-концентрированное облучение - 4,0-5,0 Гр ежедневно в течение 5 дней, например в качестве предоперационного облучения;
- ускоренное фракционирование - облучение 2-3 раза в сутки обычными фракциями с уменьшением суммарной дозы за весь курс лечения;
- гиперфракционирование, или мультифракционирование - дробление суточной дозы на 2-3 фракции с уменьшением дозы за фракцию до 1,0-1,5 Гр с интервалом 4-6 ч, при этом продолжительность курса может не измениться, но суммарная доза, как правило, повышается;
- динамическое фракционирование - облучение с различными схемами фракционирования на отдельных этапах лечения;
- сплит-курсы - режим облучения с длительным перерывом на 2-4 нед в середине курса или после достижения определенной дозы;
- низкодозный вариант фотонного тотального облучения тела - от 0,1- 0,2 Гр до 1-2 Гр суммарно;
- высокодозный вариант фотонного тотального облучения тела от 1-2 Гр до 7-8 Гр суммарно;
- низкодозный вариант фотонного субтотального облучения тела от 1-1,5 Гр до 5-6 Гр суммарно;
- высокодозный вариант фотонного субтотального облучения тела от 1-3 Гр до 18-20 Гр суммарно;
- электронное тотальное или субтотальное облучение кожи в различных режимах при ее опухолевом поражении.
Величина дозы за фракцию имеет большее значение, чем общее время курса лечения. Крупные фракции более эффективны, чем мелкие. Укрупнение фракций при уменьшении их числа требует уменьшения суммарной дозы, если не изменяется общее время курса.
Различные варианты динамического фракционирования дозы хорошо разработаны в МНИОИ имени П. А. Герцена. Предложенные варианты оказались гораздо эффективнее, чем классическое фракционирование или подведение равных укрупненных фракций. При проведении самостоятельной лучевой терапии или в плане комбинированного лечения используют изоэффективные дозы при плоскоклеточном и аденогенном раке легкого, пищевода, прямой кишки, желудка, гинекологических опухолях, саркомах
мягких тканей. Динамическое фракционирование существенно повысило эффективность облучения за счет увеличения СОД без усиления лучевых реакций нормальных тканей.
Величину интервала при сплит-курсе рекомендуется сокращать и до 10- 14 дней, так как репопуляция выживших клоновых клеток появляется в начале 3-й недели. Тем не менее при расщепленном курсе улучшается переносимость лечения, особенно в случаях, когда острые лучевые реакции препятствуют проведению непрерывного курса. Исследования показывают, что выживающие клоногенные клетки развивают настолько высокие темпы репопуляции, что для компенсации каждый дополнительный день перерыва требует прибавки примерно 0,6 Гр.
При проведении лучевой терапии используют методы модификации радиочувствительности злокачественных опухолей. Радиосенсибилизация лучевого воздействия - процесс, при котором различные способы приводят к увеличению поражения тканей под влиянием облучения. Радиопротекция - действия, направленные на снижение поражающего эффекта ионизирующего излучения.
Оксигенотерапия - метод оксигенации опухоли во время облучения с использованием для дыхания чистого кислорода при обычном давлении.
Оксигенобаротерапия - метод оксигенации опухоли во время облучения с использованием для дыхания чистого кислорода в специальных барокамерах под давлением до 3-4 атм.
Использование кислородного эффекта при оксигенобаротерапии, по данным С. Л. Дарьяловой, было особенно эффективно при лучевой терапии недифференцированных опухолей головы и шеи.
Регионарная турникетная гипоксия - метод облучения больных со злокачественными опухолями конечностей в условиях наложения на них пневматического жгута. Метод основан на том, что при наложении жгута рО2 в нормальных тканях в первые минуты падает почти до нуля, а в опухоли напряжение кислорода еще некоторое время остается значительным. Это дает возможность увеличить разовую и суммарную дозы облучения без повышения частоты лучевых повреждений нормальных тканей.
Гипоксическая гипоксия - метод, при котором до и во время сеанса облучения пациент дышит газовой гипоксической смесью (ГГС), содержащей 10 % кислорода и 90 % азота (ГГС-10) или при уменьшении содержания кислорода до 8 % (ГГС-8). Считается, что в опухоли имеются так называемые острогипоксические клетки. К механизму возникновения таких клеток относят периодическое, длящееся десятки минут резкое уменьшение - вплоть до прекращения - кровотока в части капилляров, которое обусловлено в числе других факторов повышенным давлением быстрорастущей опухоли. Такие острогипоксические клетки радиорезистентны, в случае наличия их в момент сеанса облучения они «ускользают» от лучевого воздействия. В РОНЦ РАМН этот метод применяют с обоснованием, что искусственная гипоксия снижает величину предсуществующего «отрицательного» терапевтического интервала, который определяется наличием гипоксических радиорезистентных клеток в опухоли при их практически полном отсутс-
твии в нормальных тканях. Метод необходим для защиты высокочувствительных к лучевой терапии нормальных тканей, расположенных вблизи облучаемой опухоли.
Локальная и общая термотерапия. Метод основан на дополнительном разрушительном воздействии на опухолевые клетки. Обоснован метод перегревом опухоли, который происходит в связи со сниженным кровотоком по сравнению с нормальными тканями и замедлением вследствие этого отвода тепла. К механизмам радиосенсибилизирующего эффекта гипертермии относят блокирование ферментов репарации облученных макромолекул (ДНК, РНК, белки). При комбинации температурного воздействия и облучения наблюдается синхронизация митотического цикла: под воздействием высокой температуры большое число клеток одновременно вступает в наиболее чувствительную к облучению фазу G2. Наиболее часто применяют локальную гипертермию. Существуют аппараты «ЯХТА-3», «ЯХТА-4», «PRIMUS U+R» для микроволновой (СВЧ) гипертермии с различными датчиками для прогревания опухоли снаружи или с введением датчика в полости cм. рис. 20, 21 на цв. вклейке). Например, для прогревания опухоли предстательной железы используют ректальный датчик. При СВЧ-гипертермии с длиной волны 915 МГц в предстательной железе автоматически поддерживается температура в пределах 43-44 °С в течение 40-60 мин. Облучение следует сразу за сеансом гипертермии. Имеется возможность для одновременной лучевой терапии и гипертермии («Гамма Мет», Англия). В настоящее время считается, что по критерию полной регрессии опухоли эффективность термолучевой терапии в полтора-два раза выше, чем при проведении только лучевой терапии.
Искусственная гипергликемия приводит к снижению внутриклеточного рН в опухолевых тканях до 6,0 и ниже при очень незначительном уменьшении этого показателя в большинстве нормальных тканей. Кроме того, гипергликемия в условиях гипоксии ингибирует процессы пострадиационного восстановления. Считается оптимальным одновременное или последовательное проведение облучения, гипертермии и гипергликемии.
Электронакцепторные соединения (ЭАС) - химические вещества, способные имитировать действие кислорода (его сродство с электроном) и избирательно сенсибилизировать гипоксические клетки. Наиболее употребительными ЭАС являются метронидазол и мизонидазол, особенно при локальном применении в растворе диметилсульфоксида (ДМСО), что позволяет при создании в некоторых опухолях высоких концентраций препаратов существенно улучшить результаты лучевого лечения.
Для изменения радиочувствительности тканей применяют также препараты, не связанные с кислородным эффектом, например ингибиторы репарации ДНК. К числу таких препаратов относятся 5-фторурацил, галоидированные аналоги пуриновых и пиримидиновых оснований. В качестве сенсибилизатора применяют обладающий противоопухолевой активностью ингибитор синтеза ДНК-оксимочевину. К ослаблению пострадиационного восстановления ведет также прием противоопухолевого антибиотика актиномицина Д. Ингибиторы синтеза ДНК могут быть использованы для вре-
менной искусственной синхронизации деления опухолевых клеток с целью последующего их облучения в наиболее радиочувствительных фазах митотического цикла. Определенные надежды возлагаются на применение фактора некроза опухолей.
Применение нескольких агентов, изменяющих чувствительность опухолевой и нормальной тканей к облучению, называется полирадиомодификацией.
Комбинированные методы лечения - сочетание в различной последовательности хирургического вмешательства, лучевой терапии и химиотерапии. При комбинированном лечении лучевую терапию проводят в виде предили послеоперационного облучения, в некоторых случаях используют интраоперационное облучение.
|
|
|
|
|
Дата добавления: 2015-06-27; Просмотров: 2199; Нарушение авторских прав?; Мы поможем в написании вашей работы!