
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Причини серцево-судинних захворювань
|
|
|
|
Вступ
План
Химическая метрология
Количественный химический анализ
47. Современные проблемы гравиметрического анализа.
48. Термогравиметрия как метод химического анализа и метод исследования веществ.
49. Электрогравиметрические методы анализа.
50. Проблемы оптимизации чувствительности и селективности в титриметрическом анализе.
51. Химические стандарты. Стандартные образцы. Стандартизации титрантов.
52. Кривые титрования как средство для определения количества вещества и средство исследования реакционной способности вещества.
53. Индикаторы кислотно-основного титрования.
54. Индикаторы комплексонометрического титрования.
55. Окислительно-восстановительные индикаторы.
56. Адсорбционные индикаторы.
57. Флуоресцентные и хемилюминесцентные индикаторы.
58. Индикаторные реакции и индикаторные вещества в кинетических методах анализа.
59. Ферментативные и иммунохимические методы анализа.
60. Гравиметрические, титриметрические и кинетические методы в анализе органических веществ.
61. Химические методы в анализе лекарственных препаратов.
62. Химические методы в анализе объектов окружающей среды.
63. Хемометрика и химический анализ.
64. Статистика в аналитической химии.
65. Планирование и оптимизация эксперимента.
66. Аналитический сигнал: обнаружение, измерение, обработка.
67. Автоматизация и компъютеризация методов химического анализа.
68. Теория контроля и оптимизации.
69. Аналитическая служба как система.
Аналитическая химия элементов, классов соединений, объектов
70-100. Произвольный выбор.
Вступ………………………………………………………………………...3
1. Основні міжклітинні контакти серцево-судинної системи…………..4
2. Молекули клітинної адгезії……………………………………………7
3. Серцево-судинні захворювання………………………………………..7
4. Причини серцево-судинних захворювань…………………………….8
5. Дослідження міжклітинних взаємодій у серці при патологіях……...8
6. Дослідження міжклітинних взаємодій у судинах, при патологічних станах…………………………………………………………………..16
Висновок…………………………………………………………………..21
Список використаних джерел……………………………………………22
У другій половині ХХ століття основну небезпеку для здоров'я населення і проблему для охорони здоров'я стали представляти не інфекційні захворювання, а в першу чергу хвороби серцево-судинної системи, які в даний час є провідною причиною захворюваності, інвалідизації та смертності дорослого населення. Сталося «омолодження» цих захворювань. Вони стали поширюватися і серед населення країн, що розвиваються.
Захворювання серцево-судинної системи численні. Одні з них є хворобами переважно серця, інші - головним чином артерій (Атеросклероз) чи вен, треті вражають серцево-судинні системи в цілому (Гіпертонічна хвороба). Захворювання серцево-судинної системи можуть бути обумовлені вродженою вадою розвитку, травмою, запальним процесом і іншими.
Міжклітинна комунікація між клітинами серцево-судинної системи відбувається на молекулярному рівні за допомогою особливих структур – міжклітинних контактів, які утворюються при взаємодії плазматичних мембран, екстрацелюлярного матрикса та молекул клітинної адгезії, які досить різноманітні і можуть відрізнятись при взаємодії в одних і тих самих клітинах у здоровому стані та при патології.
1. Основні міжклітинні контакти серцево-судинної системи
Міжклітинна інтеграція реалізується, насамперед, через різного роду взаємодії клітин. Міжклітинні і міжтканинні кореляції розвиваються на біохімічній і біофізичній основі. Аналізуючи проблему розвитку міжклітинних взаємодій в міокарді, необхідно враховувати два основних аспекти: 1) специфічні взаємодії між кардіоміоцитами; 2) взаємодії між кардіоміоцитами та іншими клітинними.
Одним з важливих видів міжклітинної взаємодії на рівні кардіоміоцитів є міжклітинні контакти. Як системоутворюючі елементи вони забезпечують якісний перехід від клітинного рівня організації до тканинного.
Нексуси формують основу для електротонічного поширення імпульсів збудження між кардіоііоцітами. Плазматичні мембрани клітин, що утворюють щілинний контакт (нексус), розділені щілиною шириною 2-4 нм. Коннексон - трансмембранний білок циліндричної конфігурації: складається з 6 структурних одигиць коннексіна. Два коннексона сусідніх клітин з'єднуються в міжмембранному просторі і утворюють канал між клітинами. Канал коннексона діаметром 1,5 нм пропускає іони і молекули з Мг до 1,5 кД. Щілинний контакт контролює проникність між взаємодіючими клітинами. У деяких клітинах (наприклад, гліальні) подібний механізм має важливе значення в регуляції рівня внутрішньоклітинного Са2+. Через щілинні контакти проходять низькомолекулярні речовини, що регулюють ріст і розвиток клітин. Щілинні контакти забезпечують поширення збудження - перехід іонів між м'язовими клітинами міокарда і між ГМК. Регуляція роботи нексусів у міокарді досягається зміною концентрації іонів, Са2+, перебудовами чотиривимірний структури актину, α-актиніна і вінкуліна, що входять до їх складу, і. можливо, дією фактора росту фібробластів.
Десмосоми, що виконують функцію механічного скріплення клітин, характерні для всіх етапів диференціювання серцевого м'яза. Десмосома - найпоширеніший тип міжклітинних контактів і найбільш складно організована спеціалізована структура клітинної адгезії. Об'єднує дві форми з'єднань. Одна з них - цитоплазматична пластинка - здійснює зв'язок проміжних філаментів клітини з плазматичною мембраною. Друга - зв'язок плазматичної мембрани з позаклітинним міжмембранним матеріалом в межах десмосоми. Цей матеріал називають десмоглеем. Ділянки клітинних мембран, що входять до складу десмосоми, розділені шаром десмоглею товщиною 20-30 нм. З внутрішньої сторони до плазматичної мембрани примикає цитоплазматична пластинка товщиною 10-40 нм з вплетеними в неї проміжними філаментами. У десмосоми всіх клітинних типів присутні наступні білки: плакоглобін, десмоплакіни, десмоглеїни, десмоколліни. Десмосоми підтримують структурну цілісність тканини, скріплюючи клітини між собою. Десмосоми в комплексі з проміжними філаментами надають тканині пружність і підтримують в ній зусилля натягу. Десмосоми скріплюють клітини між собою. На відміну від них, полудесмосома забезпечує прикріплення клітини до базальної мембрани. [1, 3]

Рис. 1. Щільний контакт. Зшиваючі трансмембранні білки зовнішньої частини плазматичної мембрани утворюють ланцюжки, за допомогою яких формуються непроникні для молекул локальні з'єднання між зовнішніми поверхнями двох суміжних плазматичних мембран. 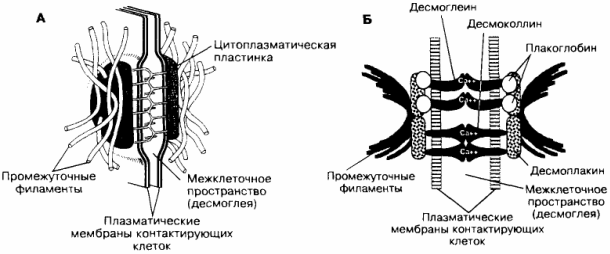
Рис. 2. Будова (А) та організація (Б) десмосоми. Плазматичні мембрани клітин розділені проміжком 20-30 нм, в якому знаходяться позамембранні частини Са2 +-зв'язуючих білків десмоглеіна і десмоколліна. До внутрішньої (цитоплазматичної) поверхні плазматичної мембрани прилягає цитоплазматична пластинка з вплетеними в неї проміжними фїламентами. До складу цієї пластинки входять десмоплакіни, плакоглобін і частина молекули десмоглеіна.
Синапс - спеціалізований міжклітинний контакт, забезпечує передачу сигналів з однієї клітини на іншу. Сигнальна молекула - нейромедіатор. Синапси формують клітини збудливих тканин (нервові клітини між собою, нервові клітини і м'язові волокна). У синапсі розрізняють пресинаптичну частина (містить синаптичні пухирці з нейромедіатором, пресинаптичних мембрану і мітохондрії), постсинаптичну частину (представлена постсинаптичні мембраною з рецепторами для нейромедіаторів, також містить мітохондрії) і розташовану між клітинами синаптичну щілину (проміжок між пре- і постсинаптичні мембранами шириною 20 - 35 нм, в синаптичну щілину з синаптичних пухирців виділяється нейромедіатор; через щілину проходить синаптична базальна мембрана) [1].
2. Молекули клітинної адгезії
В серцевій м’язовій тканині та в ГМК судин зустрічаються такі класи адгезивних молекул:
- Інтегрини - гетеродімерні молекули, що функціонують як клітинно-субстратні, так і міжклітинні адгезивні рецептори;
- Адгезивні рецептори суперсемейства іммуноглобулінов, які беруть участь у міжклітинній адгезії і особливо важливі в ембріогенезі, заживленні ран і імунній відповіді;
- Селектини - адгезивні молекули, лектинподобний домен, яких забезпечує адгезію лейкоцитів до ендотеліальних клітин;
- Кадгерини - кальційзалежні гомофільні міжклітинні адгезивні білки[1].
3. Серцево-судинні захворювання
Серцево-судинні захворювання (ССЗ) є групою хвороб серця і кровоносних судин, в яку входять:
ішемічна хвороба серця - хвороба кровоносних судин, що забезпечують кров'ю серцевий м'яз;
хвороба судин головного мозку - хвороба кровоносних судин, що забезпечують кров'ю мозок;
хвороба периферичних артерій - хвороба кровоносних судин, що забезпечують кров'ю руки і ноги;
ревмокардит - поразка серцевого м'яза і серцевих клапанів в результаті ревматичної атаки, що викликається стрептококовими бактеріями;
вроджена вада серця - будови серця, що існують з народження деформації;
тромбоз глибоких вен і емболія легенів - освіта в ножних венах згустків крові, які можуть зміщуватися і рухатися до серця і легенів.
Інфаркти і інсульти зазвичай є гострими захворюваннями і відбуваються, головним чином, в результаті закупорювання судин, яке перешкоджає потоку крові до серця або мозку. Найпоширенішою причиною цього є утворення жирових відкладень на внутрішніх стінках кровоносних судин, що забезпечують кров'ю серце або мозок. Кровотечі з кровоносної судини в мозку або згустки крові можуть також бути причиною інсульту [2].
Причини ССЗ точно встановлені і добре відомі. Основними причинами хвороб серця і інсульту є неправильне живлення, фізична інертність і вживання тютюну. Ці причини називаються "Чинниками ризику, що модифікуються,". Наслідки неправильного живлення і фізичної інертності можуть виявлятися у вигляді підвищеного кров'яного тиску, підвищеного рівня глюкози в крові, підвищеного вмісту жирів в крові, зайвої ваги і ожиріння; ці прояви називаються "Проміжними чинниками ризику".
Основні чинники ризику, що модифікуються, приводять майже до 80% випадків ішемічної хвороби серця і хвороби судин головного мозку. Існує також цілий ряд чинників, що впливають на розвиток хронічних хвороб, або " основоположних причин". Вони є віддзеркаленням основних рушійних сил, що приводять до соціальних, економічних ікультурних змін, - це глобалізація, урбанізація і старіння населення.
Іншимивизначальними чинникамидля ССЗ є стрес. Часто хвороба кровоносних судин протікає бессимптомно. Інфаркт або інсульт можуть бути першими попередженнями про захворювання [2].
5.Дослідження міжклітинних взаємодій у серці при патологіях
Як вже відомо, серцево-судинні захворювання – одна з головних причин смертності людей. Вивчення цих хвороб не могло не привернути увагу вчених, до молекулярних механізмів міжклітинної комунікації згаданих вище клітин. Так, Джоші М. Б., Ерн П. та соавтори з лабораторії для передачі сигналів, відділу біомедицини (Швейцарія) зайнялись вивченням кадгеринів при серцево-судинних захворюваннях. Серцево-судинні захворювання охоплюють величезний діапазон умов, що виникають при настільки ж різноманітній етіології. Надродина кадгеринів – клітинних молекул адгезії поверхні, вже давно визнані за їх вирішальну роль в морфогенезі і контрольованого зростання і обороту у дорослих тканинах. Таким чином, їх участь у розвитку серцево-судинних захворювань, що характеризуються тканинним ре моделюванням, може бути передбачене. Однак, враховуючи різноманітність кадгеринів, виражені на резидентних клітинах в серцевій і судинній тканинах і їх різні і часто дублюючі функції, які виходять за рамки простого посередництва адгезивної взаємодії, визначення конкретної ролі в прогресуванні серцево-судинних захворювань може бути змішаним. У порівнянні полів ембріогенезу з онкологією, дослідження, конкретно орієнтовані на участі в розмежуванні кадгеринів серцево-судинних захворюваннь є надзвичайно мізерні. Автори данного дослідження пропонують короткий вступ в члени суперсемейства кадгерін, і переглянути участь кадгеріни в серцевих захворювань (розширених і диспластичних кардіоміопатіях) і судинних захворювань (атеросклерозу і рестеноза), в яких відбуваються видні архітектурі зміни в тканинах і в кінцевому рахунку це викликає клінічні прояви та ускладнення захворювань. Передбачувані функції різних кадгеріни виражені в кардіоміоцитів, гладком'язових клітин та ендотеліальних клітин обговорюються [5].
У США (штат Техас), в інституті досліджень довголіття та старіння (відділ геріатрії, геронтології та паліативної медицини) Холад Г. В. і Ліндсі М. Л. вивчали зв'язок позаклітинного матриксу і фібробластів після інфаркту міокарда. Позаклітинний матрикс (ECM) забезпечує структурну підтримку, виступаючи в якості каркаса для клітин, і, таким чином ECM підтримує нормальний гомеостаз тканин. У відповідь на інфаркт міокарда (ІМ), ECM, як правило, посилює свою активність в лівого шлуночка (ЛШ), яка регулює ремоделювання ЛШ шляхом модуляції формування рубця. ECM безпосередньо впливає на утворення рубців, регулюючи ріст випуску фактора і клітинної адгезії і побічно впливає на утворення рубців шляхом регулювання запальних, кровоносних судин і відповідей фібробластів [10].
Члени американської фізіологічної спілки Стефані Л. К., Боуверс та ін. вивчали динаміку взаємодії фібробластів міоцитів і капілярів серця. У серці, електричні, механічні та хімічні сигнали, створюють умови необхідні для нормальної клітинної відповіді у розвитку і патологічні сигнали. Зв'язок між фібробластами, міоцитами і ендотеліальними клітинами, а також позаклітинним матриксом, мають вирішальне значення для коливань у складі серця і функції під час нормального розвитку і патології. Останні дані свідчать про те, що цитокіни відіграють важливу роль в міжклітинній сигналізації в серці. Дійсно, ми бачимо, що врезультаті взаємодії між міоцитами і серцевими фібробластами збільшується секреція інтерлейкіну-6 та фактора некрозу пухлини-α. Автори також використовували конфокальну та електронну мікроскопії для спостереження замикаючих контактів і можливого прямого зв'язку між цими клітинами в живому організмі. Отримані результати підкреслюють важливість прямих міжклітинних зв'язків в серці, і вказують, що взаємодія між фібробластами, міоцитами і ендотелієм капілярів призводить до диференціальної експресії цитокінів. Вивчення цих міжклітинних взаємодій має безліч наслідків для процесу ремоделювання серця і загальної функції серця під час розвитку та кардіопатології.
Клітинна організація серця складається в основному з міоцитів, фібробластів, клітин гладких м'язів судин і ендотеліальних клітин (ЕК). Багато чого відомо про організацію міоцитів і судин, однак мало відомо про серцеві фібробласти і їх взаємодії з міоцитами і ECS. Поєднання зовні всередину, а зсередини назовні сигналізації між екстрацелюлярним матриксом і клітинними компонентами служить для координації розвитку міокарда і фібробластів сполучної тканини. Цей динамічний стільниковий зв'язок здійснюється через поєднання механічних, хімічних і електрофізіологічних сигналів, що в кінцевому рахунку регулюють серцеву діяльність.
Щоб більш точно вивчити питання про взаємодію між серцевими фібробластами, міоцити і ЕК, що призводить до секреції цитокінів, автори дослідження провели тривимірну клітинну адгезію. Також розглянули ці міжклітинні взаємодії в природних умовах, використовуючи конфокальну та електронну мікроскопії (ПЕМ).
Попередні дослідження показали, що серцеві фібробласти і міоцити можуть взаємодіяти один з одним, і що ці взаємодії регулюються специфічними білками, такими як інтегрини, кадгерини, і коннексини.
Результати даного дослідження підкреслюють важливість прямих міжклітинних комунікацій в серці, і показують, що взаємодія між серцевими фібробластами, міоцитами і капілярним ендотелієм в результаті призводить до диференційної експресії цитокінів. Як раніше спостерігався, взаємодії між серцевими фібробластами і міоцитами є необхідним компонентом in vitro для секреції цитокінів ІЛ-6 та TNF-α. Інгібування фібробластів серцево-міоцитарної взаємодії через Cx43 антитіла збідненого IL-6 секрецію, але збільшилося вираження TNF-α. Обидва IL-6 та TNF-α, як повідомляється, викликають збільшення фібробластів коллагену. Було також показано, що збільшення гіпертрофії міоцитів викликає ремоделювання серця. Цікаво, що клінічні дослідження показують збільшення TNF-α при гіпертрофії, які були залучені в апоптоз кардіоміоцитів, а також масив захворювань. Як вже говорилося, міжклітинні зв'язки змінювалися протягом гіпертрофії серця і видужання, а також отримані дані показують, що зниження цих найважливіших міжклітинних взаємодій (наприклад, через апоптоз або збільшене утворення колагену) може бути пов'язане з підвищенням рівня і побічними ефектами TNF-α в патологічних умовах.
IL-6 являє собою запальний цитокін, який регулює біологічні функції в клітині і тканинах певним чином, в тому числі в серці. Накопичені дані свідчать про те, що IL-6 та його ефекторні шляхи, зокрема, gp130/Jak-STAT шляху, мають вирішальне значення у функціонуванні міокарда та кардіопротекції. Результати поточного дослідження, що показують, збільшення IL-6 секреції в результаті гетеротипічних міжклітинних зв'язків надалі підтримують важливу роль IL-6 в нормальній функції серця і при патологічних станах.
Кардіоміоцити відрізняються за розміром і формою в залежності від їх розташування в серці, стадії розвитку, а також у відповідь на патофізіологічні сигнали. Внесення змін до розмір або розташування міоцитів логічно вимагає корекції в розподілі чинників, які мають вирішальне значення для виживання клітин, які зазвичай опосередковуються через капілярний розподіл. Ангіогенез безпосередньо залежить від метаболічних потреб серця, і регулювання координується через міжклітинні контакти з міоцитами, фібробластами, ECS, і ECM. Цитокіни та екстра целюлярний матрикс важливі для ремоделювання судин і регуляції серцевої і несерцевих тканин.
Дані дослідження показують, що серцева комунікація має вирішальне значення для хімічних сигналів, що беруть участь у ремоделюванні серця, і вимагає подальшого вивчення. Визначення сигналів, відповідальних за зміни буде надавати уявлення про процес розвитку серця, а також етіології та лікування захворювань серця [13].
На кафедрі клітинної біології розвитку та анатомії (університет Південної Кароліни, США) Баудіно Т. А., Борг Т. З. та ін. вивчали взаємодію кардіоміоцитів і фібробластів в тривимірній культурі. Створення масивів клітин має вирішальне значення для формування і функціонування нормального органу, і це, напевно, залежить від внутрішніх і зовнішніх сигналів. Крім того, формування більшості тканин вимагає взаємодії кількох типів клітин. Дійсно, як компоненти позаклітинного матриксу (ECM), так і клітинні компоненти необхідні для формування тривимірних (3-D) тканин в пробірці. Використовуючи 3-D культури автори демонструють, що ECM, розташований у відповідністі до необхідного для паличкоподібного фенотипу міоцитів, і як тільки ця модель встановлено, міоцити були відповідальні за узгодження будь-яких подальших шарів клітин. Це аналогічно тому, як в природних умовах картина, яка спостерігається, там, де, здається, мінімальна ECM сигналізації, а формування багатоклітинних моделей залежить від міжклітинних взаємодій. Досліджувана 3-D культура міоцитів і фібробластів має велике значення, вона моделює в природних умовах організацію серцевої тканини і може бути використана для дослідження взаємодій між фібробластами і міоцитами. Крім того, автори використовували обертальні культури для вивчення клітинних взаємодій. За допомогою цих систем, вони показали, що конкретні коннексини і кадгерини є критичними для міжклітинних взаємодій. Представлені дані доцільно використовувати для дослідження клітинних взаємодій при нормальному зростанні і при патологіях [6].
В Швейцарії (в клініці дерматології) Лапуж К., Фонтао Л. та інщі проводили дослідження за темою клітинна терапія серця In Vitro: відтворювані аналізи для порівняння ефективності різних клітин донора.
Десмосомами є міжклітинні адгезивні комплекси, якірні проміжні філаменти цитоскелету в клітинній мембрані в епітелії і клітинах серцевого м'яза. Десмосомальний десмоплакін відіграє ключову роль у зв’язуванні різних проміжних мереж філаментами через його С-кінцевий домен. Щоб отримати більш повне уявлення про цитоскелетну організацію кардіоміоцитів, автори досліджували асоціацію десмоплакіна з десміном по трансфекції клітин (на дріжджах). Результати показують, що асоціація десмоплакіна з десміном залежить від послідовності в лінкерній області і С-кінцем десмоплакіна, де B і C під домени роблять внесок у ефективне зв'язування; взаємодія десмоплакіна з ненитчастим десміном вимагає послідовності, що містяться в с-кінцевій частині стрижня десмина і хвістовій області в дріжджах, в той час як дослідження в пробірці зв'язування хвіста десміна є необов'язковою для об'єднання, і мутації в будь-якому с-кінеці десмоплакіна або хвіст десміна пов'язаний з успадкованою кардіоміопатією, що, здається, погіршує десмоплакін-десмінові взаємодії. Ці дослідження поглибити розуміння проміжних взаємодій десмоплакін-нить, які мають важливе значення для підтримки цитоархітектоніки в кардіоміоцитах, і дати нове розуміння молекулярних основ десмоплакіна і десміна людини, пов'язаних із захворюваннями [11].
Дуже важливо, щоб клітини серця «правильно» взаємодіяли між собою. Вивченням цього складного питання займались вчені з відділу молекулярної кардіології (Техас) - Баудіно Т. А., Борг Т. З. та ін., а саме вони вивчали важливість десмоплакіну для властивих кардіальних міжклітинних взаємодій. Нормальна серцева функція підтримується за рахунок динамічної взаємодії серцевих клітин один з одним і з позаклітинним матриксом. Ці взаємодії мають важливе значення для реконструкції при зупинці росту і патофізіологічних умовах. Тим не менш, точні механізми цієї взаємодії залишаються неясними. У даному дослідженні розглянто важливість десмоплакіну (DSP) в міжклітинних взаємодіях серця. Міжклітинні зв'язки в серці вимагають формування та збереження клітинних контактів, з'єднання клітинної адгезії називається десмосомо-подібні структури. Основним білковим компонентом цього комплексу є DSP, який грає роль в об'єднанні цитоскелетної мережі до плазматичної мембрани. Вчені попередньо створили поліклональні антитіла (1611) по відношенню до розчинної фракції плазматичної мембрани фібробластів серця. У спробі визначити, які білки 1611 визнає, було проведено двовимірний електрофорез і визначили DSP, як однин з основних білків, розпізнаних 1611. Іммунопреціпітація дослідження показала, що 1611 був в змозі безпосередньо взаємодіяти з осадженим DSP. Вчені також показали, що 1611 і анти-DSP антитіла ко-локалізуються в цілі розділи серця. Нарешті, використовуючи тривимірні аналізи в пробірці взаємодії клітина-клітина, автори показували, що 1611 може інгібувати міжклітинні взаємодій. Ці дані показують, що DSP є важливим білком для міжклітинних взаємодій і впливає на різні клітинні функції, в тому числі секрецію цитокінів [7].
Важливе питання досліджували вчені Ярвуд Г., Масон Д. С. та ін. співавтори з національного інституту серця і легень, відділу молекулярної кардіології (Лондон, Великобританія), а саме вони вивчали скоротливі стани кардіоміоцитів, пов'язані з відмінностями у взаімодії фібронектину та інтегринів. Інтегринові ниті позаклітинного матриксу (ECM) пов'язані з внутрішньоклітинним цитоскелетом та з іншими клітинними адгезинами сигнальних білків діють в якості механотрансдукторів. Тим не менш, прямі кількісні вимірювання механічних кардіоміоцитів серця і його відносини до взаємодії між специфічними білками ECM та інтегринами не вистачає. Метою даного дослідження було охарактеризувати взаємодію між фібронектином ECM білка (FN) і інтегрином в кардіоміоцитах і перевірити гіпотезу, що ця взаємодія буде змінюватися під час скорочення і розслаблення серця в кардіоміоцитах. Використовуючи атомно-силову мікроскопію, автори кількісно визначили силу зв’язування (силу адгезії) і імовірністю адгезії між інтегринами і FN, і ці виміри корелюють з скоротливістю серця, як проіндексовані осередки жорсткості на свіжевиділених кардіоміоцитах мишей. Експерименти проводилися в нормальних фізіологічних умовах (контроль), з високим вмістом K +, або з низьким вмістом Ca2 + (повністю розслабленим). При контрольних умовах, початкового піка сила адгезії між FN і міоцитами α3β1 і / або α5β1-інтегринів склала 39,6 ± 1,3 пН. Специфічність зв'язування між FN та α3β1 і α5β1-інтегринів була перевірена за допомогою моноклональних антитіл проти α3-,-α5, α3 + α5-або β1-субодиниці інтегринів, яка інгібує зв'язування 48%, 65%, 70%, або 75%, відповідно. Стиснення з високим вмістом K + збільшило загальну клітинну адгезію (в 1,2 рази) і клітинну жорсткость (в 27,5 рази) у порівнянні з повністю розслабленими клітинами з низьким вмістом Ca2 +. Розчин з високим вмістом K +, що містить BDM, який пригнічує скорочення шляхом інгібування актин-міозінових взаємодій. Таким чином, результати показують, що адгезія інтегрина з FN модулюється скорочувальними станами кардіоміоцитів [5].
6.Дослідження міжклітинних взаємодій у судинах, при патологічних станах
Лісія Тотані та Вірджиліо Евангеліста в лабораторії в лабораторії судинної біології та фармакології (Італія) провели дослідження за темою тромбоцитарно-лейкоцитарні взаємодії при серцево-судинних захворювань і у наступний період.
Взаємодії тромбоцитів і лейкоцитів визначають основні процеси клітини, які характеризуються обміном сигналів між тромбоцитами і різними типами лейкоцитів, і поєднує в собі дві фундаментальних фізіологічних і патологічних події: атеротромбоз і імунні запальні реакції. Коли цей процес відбувається на місці атеросклеротичної бляшки або розвитку на місці пошкодження ендотелію, тромбоцити залежать від лейкоцитів і сприяють активації запальної реакції судинної стінки, на яку припадає загострення атеросклерозу. Крім того, взаємодії тромбоцитів і лейкоцитів можуть відігравати ключову роль в модуляції широкого спектра відповідей як вродженої і адаптивної імунної системи, тим самим сприяючи патогенезу запальних захворювань і ушкоджень тканин, а також для забезпечення захисту.
Початковий контакт тромбоцитів і лейкоцитів виробляється в експозиції P-селектину. Після зв'язування, PSGL-1 тригери активації залежать від конформаційних змін в β2-інтегринів, які в основному включають Mac-1, а також сприяють адгезії нейтрофілів. Аналогічним чином, тромбоцити обов'язково викликають «липкість» β1- і β2- інтегринів до моноцитів і сприяє зв'язуванню лімфоцитів лімфатичних вузлів, що полегшує доставку лімфоцитів у високі ендотеліальні венули, і лімфоцитів самонаведення під час адаптаційної імунної відповіді.
На додаток до прямих міжклітинних взаємодій, активовані тромбоцити можуть продукувати хемокіни, на поверхні запаленого або атеросклеротичного ендотелію. Таким чином, активовані тромбоцити залишають "повідомлення" на стінці судини, яке можуть «читати» циркулюючі моноцити, і це може призвести до їх вербування та запальної активації на сайтах, схильних до атеросклерозу.
У сукупності дані обговорювані вище, показують, що тромбоцити сприяють запаленню через активацію лейкоцитів. Це досягається за рахунок індукції адгезії інтегринів і хемотаксису, шляхом стимуляції швидкого реагування, таких як випуск реактивних форм кисню, мієлопероксидази і протеази нейтрофілів, і викликаючи внутрішньоклітинні сигнали, що приводять до запальних реакцій і протромботичної експресії генів у моноцитах.
Лісія Тотані та Вірджиліо Евангеліста підтримують концепцію, що взаємодії тромбоцитів і лейкоцитів повинні відігравати ключову роль у розвитку запальної реакції судинної стінки, які є основоположними для ініціації і прогресуванні атеросклерозу. Крім атеросклерозу і гострого тромбозу, взаємодії тромбоцитів і лейкоцитів беруть участь у різних запальних захворювань, яке підтримує думку про те, що тромбоцити є основними партнерами імунної системи. В ході цих взаємодій, тромбоцити викликати внутрішньоклітинні сигнали в імунних клітинах, і таким чином, вони модулюють імунні запальні реакції.
Нарешті, взаємодія тромбоцитів з нейтрофілами могло б сприяти проведенню оборони, шляхом стимулювання формування нейтрофільних позаклітинних пасток, щоб заманити бактерій [9].
Також Бострем K. I., Toулер Д. A. – вчені з департаменту медецини, відділу кардіології при Каліфорнійському університеті (США) займались вивченням регулювання клапанного і судинного склерозу остеогенними морфогенами. Судинна кальцифікація більше вражає нас при старінні - дисметаболічне населення. Раніше це вважали тільки пасивним процесом мертвих і вмираючих клітин, кальцифікації судин в даний час перетворилася в строго регулюючу форму біомінералізації, яка організована колагеновими і еластиновими позаклітинними матрицями. Під час формування скелетних кісток, паракринних епітеліальних та ендотеліальних мезенхімальних-мезенхімальні взаємодії контролює остеохондроцитарні диференціації мультіпотентних мезенхімальних клітин-попередників. Ці паракринні остеогенні сигнали, опосередковані потужним морфогенним білком типу MMTV сайту інтеграції членів родини (Wnt), також є активними в програмуванні артеріальної клітини остеопрогенітора під судинною і клапанною кальцифікаціями. Запальні цитокіни, активні форми кисню, і підвищення окиснення ліпідів, в клінічних умовах атеросклероз, цукровий діабет, уремія, які сприяють атеросклеротичній кальцифікації. Конкретні позаклітинні і внутрішньоклітинні інгібітори кісткових морфогенетичних Wnt-сигнальних білків були визначені в якості внеску в регулюванні остеогенної мінералізації в процесі розвитку і хвороби. Ці шляхи інгібуючі і їх регулятори дозволяють собі розвиток нових терапевтичних стратегій для профілактики і лікування клапаного і судинного склерозу [8].
Вивчення ендотеліальних клітин судин зацікавило Хаскарда Д. О. та соавт., які дослідили, що відпочиваючі та активовані Т-клітини індукують експресію Е-селектину і VCAM-1 на ендотеліальних клітинах судин через контакт-залежний, але CD40 ліганд-незалежний механізм. Вчені досліджували вплив на ендотеліальні клітини (ЕК) активізацію контактів Т-лімфоцитів, яка відбувається під час еміграції лімфоцитів в запалені тканини. Додавання Т-клітин пупкової вени або шкірних капілярів моношарів ЕС стимулює експресію EC E-селектину і VCAM-1. Ця відповідь вимагає прямих взаємодій клітини: клітина контакт, але не активація Т-клітин. Відпочинок CD4 + Т-клітин, щоб активувати ЄС був обмежений CD45RO + і може бути підвищена на 6 год престимуляцією Т-клітин з PMA і іономіцином. EC-стимулюючий потенціал спокою або активованих Т-клітин не залежить від ліганда CD40. Крім того, пригнічення ФНО-α / β і IL-1α / β, разом з лігандом CD40, не змогли перешкоджати EC активацію Т-клітин. Отримані дані показують, що Т-клітини-EC взаємодії можуть призводити до активації ЕС через новий контакт-залежний, але CD40 ліганд-незалежний, механізм. Добре відомо, що активація ендотеліальних клітин судин (ЕК) і регуляції адгезії EC-молекули є одним з найважливіших компонентів набору лейкоцитів у місцях запалення. Регулювання активації EC розчинних медіаторів запалення, у тому числі фактора некрозу пухлини (ФНП) та інтерлейкіну (IL) -1, була широко вивчена, і такі посередники, безсумнівно, є важливими в початковій індукції EC зчеплення молекул і тим самим і адгезії лейкоцитів до ендотелію. Тим не менш, контакти між лейкоцитами і ендотеліальними клітинами можуть впливати на поточні функції ендотеліальних клітин.
У попередніх дослідженнях запропонована концепція, що Т-лімфоцити можуть впливати на ЕС активації через міжклітинні контакти. У цьому дослідженні, автори відправилися далі, щоб охарактеризувати здатність Т-клітин, щоб стимулювати EC зчеплення молекул і досліджувати механізми, що лежать в контакт-опосередкованих сигналах. Зокрема, і на відміну від попередніх досліджень, вони зосередилися на наслідках відпочинку Т-клітини людини. Такий підхід полягає в соінкубаціі Т-клітин моношару з ЄС з різною періодичністю, використовуючи це як модель впливу поточної експозиції ендотелію в еміграції Т-клітин.
В ході попередніх експериментів, спрямованих на перевірку можливостей лімфоцитів стимулювати адгезію молекул ЕС, виявили, що свежовиділені «відпочиваючі» Т-клітини здатні стимулювати виділення E-селектину і VCAM-1, що було виявлено за допомогою ІФА. Ступінь стимуляції E-селектину, І VCAM-1 (неопубліковані результати) виділення залежало від кількості доданих Т-клітин.
У цьому дослідженні сокультивуровали свежовиділенні, відпочиваючі Т-клітини з ЕС, щоб охарактеризувати потенціал контактної взаємодії між двома типами клітин для активації виділення (синтезу) E-селектину і VCAM-1 ЕС. Спостереження авторів, що DMEC реагує подібним чином на HUVEC, підкреслює значимість цього ефекту щодо подій, які можуть відбуватися в мікроциркуляторному руслі протягом запальних реакцій в природних умовах.
Автори дослідження вважають, що їх спостереження не можуть бути пояснені в результаті забруднення лімфоцитів або EC препаратів з іншими клітинами крові. По-перше, хоча активовані тромбоцити являють собою потенційне джерело IL-1, вони встановили за допомогою проточної цитометрії з використанням анти-інтегринів α IIb мат, що Т-клітинні препарати, забруднені тромбоцитами. По-друге, Т-клітини пройшли суворе виснаження NK клітин і моноцитів. Нарешті, HUVEC були використані на третьому проході і DMEC, в уривках 4-6, в якому не виявляються мононуклеарні клітини, які могли бути отримані з пупкової крові.
Хоча використовувались невідповідні комбінації Т-клітин і ЄС, вчені вважають, що алогенна відповідь навряд чи пояснить спостереження.
Взяті разом, отримані результати показують, що прямий вплив активуючих Т-клітин опосередковані фактором (і) експресуються на Т-клітинній поверхні мембрани. Автори вважають, що малоймовірно, що ефект є результатом експресії ІЛ-1α та ФНП-α на Т-клітинної поверхні, з кількох причин. (1) Відпочиваючи Т-клітини виділять незначну кількість цих клітинної поверхневих цитокінів, (2) рекомбінантні IL-1ra, разом з коктейлем з МКА проти IL-1α, IL-1β, TNF-α, TNF-β та TNF-R p55 МАБ, не тормозят дію на індукцію VCAM-1, відпочиваючих Т-клітин. Отримані дані свідчать про існування механізму, в якому відпочиваючі і активовані Т-клітини можуть стимулювати EC зчеплення молекул виражені через прямі контакти з ЕС [12].
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 3085; Нарушение авторских прав?; Мы поможем в написании вашей работы!