
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач
|
|
|
|
Задача 1. Вычислить [Н+], [ОН-] и рН раствора, образовавшегося в результате смешивания 30 мл 0,1М раствора уксусной кислоты СН3СООН и 50 мл 0,3М раствора ацетата калия СН3СООК.
Решение:
1. Общий объем образовавшегося раствора образовавшегося в результате смешивания Vобщ= 30 + 50= 80 мл.
2. Концентрации уксусной кислоты и ацетата калия после смешивания
[СН3СООН] = 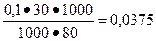 моль/л,
моль/л,
[СН3СООК] = 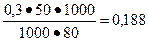 моль/л.
моль/л.
Так как ионы водорода образуются только за счет диссоциации уксусной кислоты, а ацетат анионы также и за счет диссоциации ацетата калия, то, принимаяколичество диссоцированной кислоты за Х, получим:
[СН3СООН]ост = (0,0375 – Х) моль/л; [Н+]= Х моль/л;
[СН3СОО-] = (0,188+ Х) моль/л.
Из уравнения КHan =  ; 1,74
; 1,74 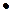 10-5 =
10-5 = 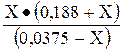
Так как Х<< 0,0375 то им можно пренебречь.
Тогда Х = [H+] = 3,5 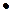 10-6 моль/л; [OH-] = 2,85
10-6 моль/л; [OH-] = 2,85 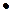 10-9 моль/л;
10-9 моль/л;
рН= – lg (3,5 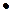 10-6) = 5,46.
10-6) = 5,46.
Такой же результат может быть получен, если пользоваться уравнением 1.
рН = рКНА – lg  = – lg (1,74
= – lg (1,74 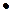 10-5) – lg
10-5) – lg 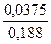 = 4,76 – (– 0,7) = 5,46.
= 4,76 – (– 0,7) = 5,46.
Ответ: [H+] = 3,5  10-6 моль/л; [OH-] = 2,85
10-6 моль/л; [OH-] = 2,85  10-9 моль/л; рН = 5,46.
10-9 моль/л; рН = 5,46.
Пример 2. Определить рН раствора, получившегося в результате смешения равных объемов растворов 0,12М СН3СООН и СН3СООК.
Ответ. После смешения Скис= Ссоль= 0,12/2=0,06 моль/л.
Пользуясь уравнением рН = рКНА - lg 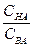 = –lg (1,74
= –lg (1,74  10-5 ) – lg
10-5 ) – lg 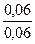 =
=
= 4,76 – lg1 = 4,76 - 0 = 4,76.
Ответ: рН = 4,76
Пример 3. Сколько миллилитров 0,25м раствора ацетата калия СН3СООК следует прибавить к 50 мл 1,0 м раствора уксусной кислоты СН3СООН, чтобы получить буферную систему с рН=3,0?
Ответ: Подставим соответствующие значения в формулу:
рН = рКНА – lg 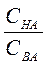 ;
;
lg  = рКНА – рН = 4,76 – 3= 1,76;
= рКНА – рН = 4,76 – 3= 1,76;
 = 101,76 = 57,5.
= 101,76 = 57,5.
Это означает, что после смешения растворов в полученном растворе концентрация кислоты в 57,5 раза должна быть выше, чем концентрация соли. С растворе имеется 0,05  1,0 = 0,05 моль кислоты. Следовательно, количество вещества соли в этом растворе должно быть в 57,5 раза меньше, а именно 0,05:57,5=0,00087 моль ацетата калия.
1,0 = 0,05 моль кислоты. Следовательно, количество вещества соли в этом растворе должно быть в 57,5 раза меньше, а именно 0,05:57,5=0,00087 моль ацетата калия.
V=0,00087/ 0,25 = 0,00348л = 3,48 мл.
Ответ: V = 3,48 мл.
Задача 4. Буферная система, состоящая из дигидрофосфата калия КН2РО4 и гидрофосфата калия К2НРО4 приготовлена при мольном соотношении солей 16: 1. Определить рН данного раствора.
Ответ: В данном случае кислотой является КН2РО4, то есть кислота Н2РО4- (из таблицы К2= 6,2 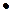 10-8 или рК = 7,2).
10-8 или рК = 7,2).
Используя уравнение рН = рКНА – lg, получим: рН = 7,2 – lg16= 6,0
Ответ: рН = 6.
Задача 5. Вычислить рН буферного раствора, содержащего 0,2 М NH4Cl и 0,2 М NH4OH.
В соответствии с уравнением 2,
рН=14 – рКВОН + lg 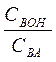 .
.
Так как рК (NH4ОН) = 4,755, то
рН = 14 – 4,755 + lg  = 9,25.
= 9,25.
Ответ: рН = 9,25.
Варианты задач по теме 3.1.3. буферные растворы
1. Что такое буферные растворы? На чем основано их буферное действие. Какое применение находят буферные растворы в быту, технике и науке?
2. Из каких веществ готовят буферные растворы? Можно ли приготовить буферный раствор исходя только из двух солей?
3. Приведите пример буферных растворов, состоящих из смеси солей.
4. Почему рН буферных растворов не меняется при их разбавлении?
5. Не прибегая к эксперименту, определите рН ацетатного и аммиачного буферных смесей, при условии, что в этих буферах концентрация соли равна концентрации кислоты (основания).
6. Какие параметры определяют буферную емкость?
7. Дайте определение понятию “Буферная емкость”.
8. Можно ли приготовить буферный раствор, смешивая сильную кислоту с её солью с сильным основанием или сильное основание с его солью с сильной кислотой?
9. Можно ли, исходя из одних и тех же компонентов, приготовить буферные смеси с различными значениями рН в широком диапазоне? Ответ мотивируйте с математическими выводами.
10. Вычислить рН и рОН буферной смеси, содержащей 0,1 мгидроксида аммония и 0,01м нитрата аммония.
11. Определить рН буферной смеси, состоящей из 0,01м раствора муравьиной кислоты и 0,02 м раствора формиата калия.
12. Сколько граммов формиата калия НСООК следует взять, чтобы при растворении в 25 мл 0,03м раствора муравьиной кислоты НСООН, получить смесь с рН=4,0?
13. 4,9г безводного ацетата калия растворили в 250мл 0,2н раствора уксусной кислоты. Определить рН раствора.
14. Сколько граммов хлорида аммония нужно растворить в 20 мл 0,5м раствора гидроксида аммония, чтобы получить концентрацию гидроксид ионов 5 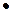 10-4 моль/л.
10-4 моль/л.
15. Рассчитать рН буферного раствора, содержащего в 0,5л 30г уксусной кислоты и 41,0г ацетата натрия.
16. Рассчитать рН и рОН раствора, если в 1,0 литре содержится 11,5г муравьиной кислоты и 10,5г формиата калия.
17. К 100 мл аммонийной буферной смеси добавили 400мл воды. Каков будет рОН раствора, если исходный имел рН равным 10,2?
18. Определить рН буферного раствора, содержащего 1,1М NH4OH и 1,1М NH4Cl.
19. Определить рН буферного раствора, полученного при смешении 50 мл 0,1М раствора дигидрофосфата калия КН2РО4 и 25 мл 0,2М раствора гидрофосфата калия К2НРО4.
20. Определите рН буферной смеси, приготовленной сливанием 15 мл с (СНзСООН) = 0,5 моль/л с 25 мл с (CH3COONa) == 0,2 моль/л. Диссоциацию соли считать полной.
21. В каком соотношении нужно смешать раствор с (СНзСООН) = 0,4 моль/л с раствором ацетата натрия с (CH3COONa) = 0,1 моль/л, чтобы рН полученного раствора был равен 4,44? Соль диссоциирует полностью.
22. Сколько миллилитров раствора с (СН3СООН) == 0,2 моль/л нужно прибавить к 50 мл раствора с (CH3COONa) == 0,25 моль/л, чтобы рН полученного раствора был равен 6? Диссоциацию соли считать полной.
23. Сколько миллилитров раствора с (NН4Сl) = 0,5 моль/л нужно прибавить к 20 мл раствора с (NH4OH) = 0,2 моль/л, чтобы рН полученного раствора был равен 9,2? Диссоциацию соли считать полной.
24. Сколько безводного ацетата натрия нужно добавить к 0,5 л раствора с (СНзСООН) = 1 моль/л, чтобы рН раствора стал равным 4? Константа диссоциации уксусной кислоты К = 1,8 • 10-5. Диссоциацию соли считать полной.
25. Определите рН смеси аммиака и хлорида аммония, если она приготовлена из растворов молярной концентрации, равной 0,1 моль/л этих веществ в отношении 1: 9. Диссоциацию соли считать полной.
26. К раствору уксусной кислоты объемом 100 мл молярной концентрации 0,3моль/л, добавлен раствор едкого натра объемом 30 мл молярной концентрации, равной 0,1 моль/л. Найдите рН полученного раствора.
27. Чтобы изменить рН на 1, к ацетатной буферной смеси объемом 10 мл потребовалось добавить раствор щелочи объемом 0,52 мл молярной концентрации 1 моль/л. Найти буферную емкость этой смеси.
28. Рассчитайте рН буферного раствора, состоящего из раствора NH3 (концентрация NH3 =0,2 моль/л) и NH4CI (C = 0,1моль/л).
29. Опишите приготовление 1 л буферного раствора с рН=5,55 из раствора ацетата натрия (С1=0,3 моль/л) и раствора соляной кислоты (С2=0,3 моль/л).
30. Рассчитать рН и рОН раствора, если в 1,0 литре растворе содержится 20г уксусной кислоты и 20,5г ацетата натрия.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 58302; Нарушение авторских прав?; Мы поможем в написании вашей работы!