
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции
|
|
|
|
Лекция 6
Все химические реакции можно разделить на два типа. К первому из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ. Например:
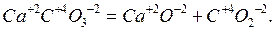
Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ. Например:
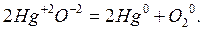
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называют окислительно-восстановительными. Можно дать ещё одну формулировку: окислительно-восстановительные реакции – это реакции, при которых происходит переход электронов от одних атомов к другим.
Рассмотрим основные положения теории окислительно-восстановительных реакций:
1. Окислением – называется процесс отдачи электронов атомом, молекулой или ионом. Степень окисления при этом повышается. Например:
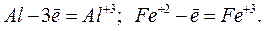
2. Восстановлением – называют процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается. Например:
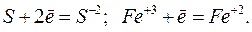
3. Атомы, молекулы или ионы, отдающие электроны, называют восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называют окислителями. Во время реакции они восстанавливаются. В качестве восстановителей в аналитической химии чаще всего используют сероводород 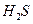 в кислой среде, сернистую кислоту
в кислой среде, сернистую кислоту 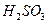 , оксид серы (IV)
, оксид серы (IV) 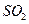 , йодоводородную кислоту
, йодоводородную кислоту 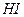 , свободные металлы и т. д. В качестве окислителей используют свободные галогены
, свободные металлы и т. д. В качестве окислителей используют свободные галогены 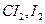 , азотную кислоту
, азотную кислоту 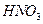 , перманганат калия
, перманганат калия 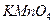 , пероксид водорода
, пероксид водорода 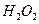 , висмутат натрия
, висмутат натрия 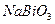 , дихромат калия
, дихромат калия 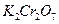 .
.
4. Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением:
При вычислении степени окисления в химических соединениях следует помнить:
1) в целом молекула электронейтральна;
2) степень окисления атомов водорода +1, за исключением гидридов, где его степень окисления равна -1;
3) степень окисления атомов кислорода равна -2;
4) степень окисления щелочных металлов +1.
В ионных соединениях, содержащих простые анионы, степень окисления иона определяется его электрическим зарядом, например 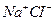 . В соединениях, содержащих сложные анионы, вначале расставляют степени окисления над элементами, имеющими постоянные степени окисления. Например, в
. В соединениях, содержащих сложные анионы, вначале расставляют степени окисления над элементами, имеющими постоянные степени окисления. Например, в 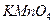 степень окисления
степень окисления 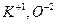 . Исходя из алгебраической суммы зарядов атомов кислорода (-8) и калия (+1), можно определить степень окисления атома марганца, учитывая электронейтральность молекулы, -
. Исходя из алгебраической суммы зарядов атомов кислорода (-8) и калия (+1), можно определить степень окисления атома марганца, учитывая электронейтральность молекулы, - 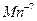 .
.
Окислительно-восстановительные реакции делятся на следующие типы:
реакции межмолекулярного окисления-восстановления:
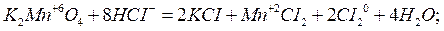
реакции внутримолекулярного окисления-восстановления. В таких реакциях обмен электронами происходит между атомами разных элементов, входящих в состав одной молекулы:
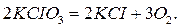
или одного элемента, входящего в состав одной молекулы, но находящегося в разных степенях окисления:
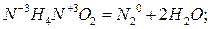
реакции самоокисления-самовосстановления. В этом случае происходит распад вещества на соединения одного и того же элемента одновременно более низкой и более высокой степеней окисления (реакция диспропорционирования):
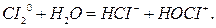
При составлении уравнения окислительно-восстановительной реакции необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов. Как правило, коэффициенты подбирают, используя либо метод электронного баланса, либо метод электронно-ионного баланса (так называемый метод полуреакций).
В качестве примера составления уравнений окислительно-восстановительных реакций рассмотрим процесс окисления меди концентрированной азотной кислотой:
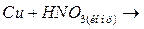
Прежде всего определим продукты реакции. 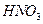 является сильным окислителем, поэтому медь будет окисляться до
является сильным окислителем, поэтому медь будет окисляться до 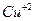 , при этом
, при этом 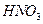 восстанавливается до
восстанавливается до 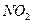 :
:
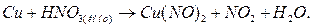
Вначале уравняем данную реакцию методом электронного баланса.
Процесс восстановления:
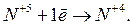
Процесс окисления:
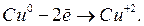
Общий баланс:
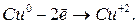
| |
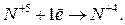
| |
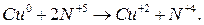
|
Две молекулы 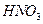 идут на окисление
идут на окисление 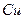 , и ещё две молекулы
, и ещё две молекулы 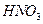 нужны на образование
нужны на образование 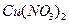 :
:
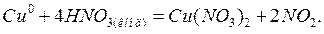
Чтобы уравнять водород и кислород, добавляем в правую часть две молекулы воды:
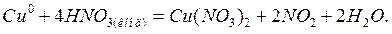
Применим метод электронно-ионного баланса. В этом методе рассматривают переход электронов от одних атомов или ионов к другим с учётом характера среды (кислая, щелочная или нейтральная), в которой протекает реакция. При составлении уравнений процессов окисления и восстановления используются реально существующие частицы в растворе. Кроме того, как и при составлении сокращённых ионных уравнений, вещества мало диссоциирующие, плохо растворимые или выделяющиеся в виде газа следует писать в молекулярной форме.
Рассмотрим для нашего случая полуреакцию окисления:
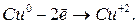
Рассмотри теперь полуреакцию восстановления нитрат-иона:
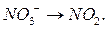
Уравниваем слева и справа атомы кислорода, добавив справа молекулу воды. Тогда слева следует добавить два атома водорода в виду существующих в растворе ионов 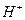 :
:
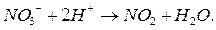
Для уравнивания заряда к левой части (заряд + 1) добавим 1 электрон:
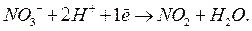
Окончательно имеем:
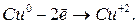
| |
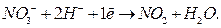
| |
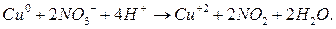
|
Получили сокращённое ионное уравнение окислительно-восстановительной реакции. Добавив в обе части соответствующее количество ионов 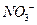 :
:
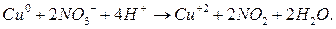
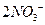
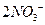
получим молекулярное уравнение реакции:
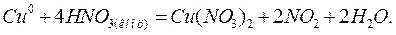
Метод электронно-ионного баланса более правилен и универсален по сравнению с методом электронного баланса и имеет неоспоримое преимущество при подборе коэффициентов во многих окислительно-восстановительных реакциях, в частности с участием органических соединений, в которых даже процедура определения степеней окисления в некоторых случаях является очень сложной.
Рассмотрим, например, процесс окисления этилена 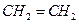 , проходящий при пропускании его через водный раствор перманганата калия
, проходящий при пропускании его через водный раствор перманганата калия 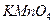 . В результате этилен окисляется до этиленгликоля
. В результате этилен окисляется до этиленгликоля 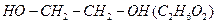 , а перманганат восстанавливается до оксида марганца (IV):
, а перманганат восстанавливается до оксида марганца (IV):
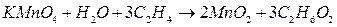
Кроме того, как будет видно из итогового уравнения баланса, образуется также гидроксид калия:
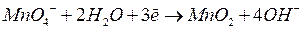
| |
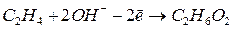
| |
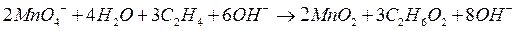
|
После проведения сокращений и в правой, и в левой частях 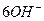 , записываем уравнение в окончательном молекулярном виде, добавив в обе части ионы калия:
, записываем уравнение в окончательном молекулярном виде, добавив в обе части ионы калия:
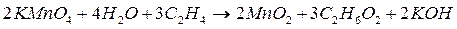
Метод электронно-ионного баланса позволяет учитывать реакцию среды. Например:
Кислая среда. 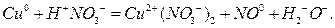
Из степеней окисления видно, что в результате реакции атом меди окисляется до катиона 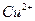 , а анион
, а анион 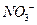 восстанавливается до оксида азота
восстанавливается до оксида азота 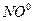 .
.
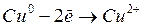
| ||
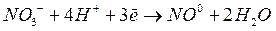
|
Суммируя оба уравнения, получим:
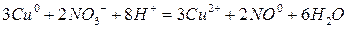
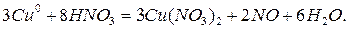
Щелочная среда. 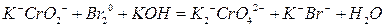
Полуреакции:
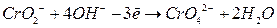
| ||
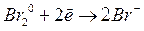
|
Суммарная ионная реакция:
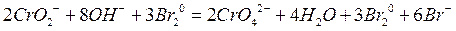
молекулярная:
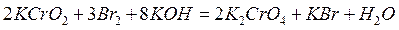
В рассмотренном методе составления уравнений реакций априори предполагалось, что данная реакция возможна. Можно ли предсказать направление окислительно-восстановительной реакции? Как и в общем случае любой химической реакции, определяющим фактором служит знак изменений изобарного потенциала. Если изменение энергии Гиббса окислительно-восстановительной реакции меньше нуля, то реакция будет протекать в прямом направлении. Если же указанное изменение энергии больше нуля (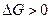 ), то прямая реакция в данных условиях невозможна, а возможна лишь обратная реакция. Для расчёта
), то прямая реакция в данных условиях невозможна, а возможна лишь обратная реакция. Для расчёта 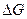 реакции используются
реакции используются 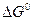 реакций образования продуктов и исходных веществ, которые для стандартных состояний приводятся в справочниках.
реакций образования продуктов и исходных веществ, которые для стандартных состояний приводятся в справочниках.
Рассмотрим для примера взаимодействие магния и палладия с водой:
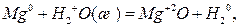
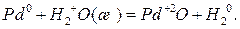
Для первой реакции 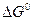 =-94,5 кДж/моль. Следовательно, окисление магния водой в этих условиях возможно, а обратная реакция водорода оксидом магния невозможна. Изменение стандартной энергии Гиббса второй реакции равно +126,5 кДж/моль, и прямая реакция окисления палладия водой невозможна. При данных условиях возможно лишь окисление водорода оксидом палладия.
=-94,5 кДж/моль. Следовательно, окисление магния водой в этих условиях возможно, а обратная реакция водорода оксидом магния невозможна. Изменение стандартной энергии Гиббса второй реакции равно +126,5 кДж/моль, и прямая реакция окисления палладия водой невозможна. При данных условиях возможно лишь окисление водорода оксидом палладия.
Для более точного расчета следует пользоваться уравнением изотермы химической реакции:
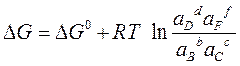
или для разбавленных растворов:
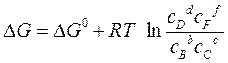
О направлении окислительно-восстановительной реакции можно судить также по величине и знаку стандартных окислительно-восстановительных потенциалов 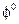 . Значение
. Значение 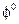 характеризует полуреакции восстановления следующего общего вида:
характеризует полуреакции восстановления следующего общего вида:
{окисленная форма}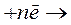 {восстановленная форма}
{восстановленная форма}
Величину окислительно-восстановительного потенциала можно определить, Пользуясь уравнением Нернста:
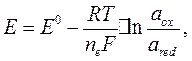
где 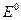 - стандартный окислительно-восстановительный потенциал данной системы;
- стандартный окислительно-восстановительный потенциал данной системы;
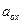 - активности окисленной формы;
- активности окисленной формы;
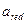 - активности восстановленной формы;
- активности восстановленной формы;
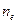 - количество электронов, принимающих участие в окислительно-восстановительной реакции.
- количество электронов, принимающих участие в окислительно-восстановительной реакции.
Стандартным окислительно-восстановительным потенциалом называется электродный потенциал, измеренный при стандартных условиях (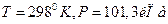 ) в растворах с активностью ионов, равной единице. Он является объективной характеристикой «силы» данного окислителя или восстановителя. Чем больше положительное значение потенциала, тем более сильным является окислитель. Например, стандартный окислительно-восстановительный потенциал редокс-пары галоген\галогенид уменьшается в ряду
) в растворах с активностью ионов, равной единице. Он является объективной характеристикой «силы» данного окислителя или восстановителя. Чем больше положительное значение потенциала, тем более сильным является окислитель. Например, стандартный окислительно-восстановительный потенциал редокс-пары галоген\галогенид уменьшается в ряду
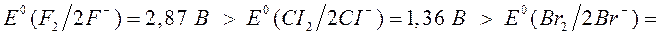
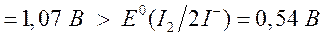
Следовательно, более сильным окислителем является фтор, а наименее сильным среди галогенов является йод.
Для разбавленных растворов активности можно заменить концентрацией, так как коэффициенты активности в этом случае близки к единице:
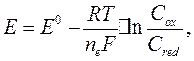
Например, для реакции
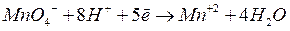
уравнение Нернста имеет вид:
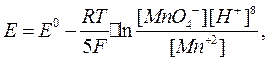
Концентрация воды при составлении уравнения принимается за постоянную величину (так как она находится в избытке и её величина в ходе реакции изменяется незначительно) и входит в состав стандартного окислительно-восстановительного потенциала.
Если в окислительно-восстановительной реакции принимают участие ионы водорода, то 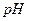 влияет на величину окислительно-восстановительного потенциала. Например:
влияет на величину окислительно-восстановительного потенциала. Например:
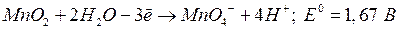
кислая среда
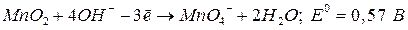
щелочная среда
Следовательно, изменяя концентрацию ионов водорода, можно уменьшать или увеличивать окислительно-восстановительный потенциал, что даёт возможность проводить желаемые реакции окисления восстановления данных ионов в присутствии ионов других окислителей и восстановителей. Например, подбирая соответствующие буферные смеси, отличающиеся друг от друга определённым значением 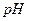 раствора, т. е. меняя концентрацию ионов водорода в реагирующей смеси, можно последовательно (или раздельно) окислять перманганатом галогенид-ионы
раствора, т. е. меняя концентрацию ионов водорода в реагирующей смеси, можно последовательно (или раздельно) окислять перманганатом галогенид-ионы 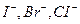 при их совместном присутствии. Изменяя
при их совместном присутствии. Изменяя 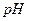 , можно даже изменять направление реакции. Например, реакция
, можно даже изменять направление реакции. Например, реакция
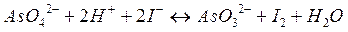
в кислой среде протекает слева направо, а в нейтральной и щелочной = справа налево.
Алгебраическое значение стандартного окислительно-восстановительного потенциала, как уже сказано, характеризует окислительную активность соответствующей окислительной формы. Поэтому сопоставление значений стандартных окислительно-восстановительных потенциалов позволяет ответить на вопрос: протекает та или иная окислительно-восстановительная реакция? Количественным критерием оценки возможности протекания той или иной окислительно-восстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления:
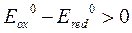
Например, реакция
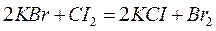
состоит из пар 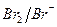 и
и 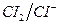 . Для рассматриваемых пар стандартные потенциалы равны
. Для рассматриваемых пар стандартные потенциалы равны 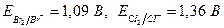 . Пара с большим стандартным потенциалом будет играть роль окислителя по отношению к паре с меньшим стандартным потенциалом. Так как
. Пара с большим стандартным потенциалом будет играть роль окислителя по отношению к паре с меньшим стандартным потенциалом. Так как 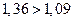 , то реакция будет протекать в направлении окисления
, то реакция будет протекать в направлении окисления 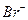 до свободного
до свободного 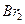 .
.
Если же учитывать активности ионов, принимающих участие в реакции окисления-восстановления, получим:
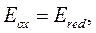 или
или
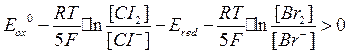
Запишем данное уравнение в общем виде для системы, находящейся в равновесии:
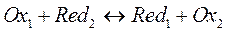
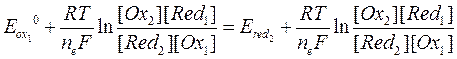
После несложного преобразования получим
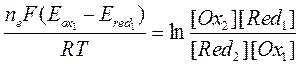
Выражение 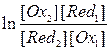 представляет собой логарифм константы равновесия
представляет собой логарифм константы равновесия 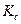 . Тогда
. Тогда
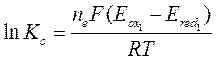
Большая величина рассчитанной константы равновесия показывает, что реакция по приведённому уравнению протекает практически необратимо. Однако большое числовое значение константы равновесия ещё не гарантирует высокой скорости реакции. Константа равновесия даёт возможность рассчитать концентрации веществ при наступлении равновесия, но не позволяет предвидеть, как скоро оно наступит.
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1477; Нарушение авторских прав?; Мы поможем в написании вашей работы!