
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ряд напряжений металлов
|
|
|
|
Уравнение Нернста
Ряд стандартных электродных потенциалов (напряжений).
Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получают ряд напряжений Николая Николаевича Бекетова (1827-1911), или ряд стандартных электродных потенциалов. Числовые значения стандартных электродных потенциалов для ряда технически важных металлов приведены в таблице.
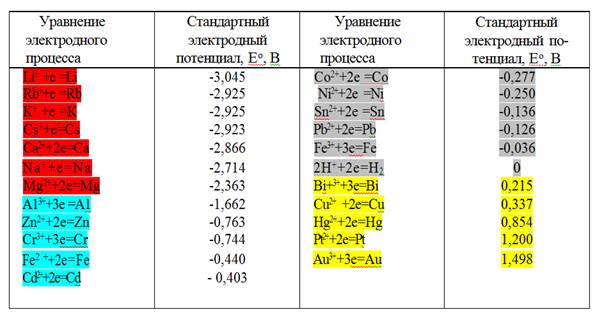
|
1. Чем меньшее значение имеет электродный потенциал металла, тем он химически активнее, легче окисляется и труднее восстанавливается из своих ионов. Активные металлы в природе существуют только в виде соединений Na, K,..., встречаются в природе, как в виде соединений, так и в свободном состоянии Cu, Ag, Hg; Au, Pt - только в свободном состоянии;
2. Металлы, имеющие более отрицательный электродный потенциал, чем магний, вытесняют водород из воды;
3. Металлы, стоящие в ряду напряжений до водорода, вытесняют водород из растворов разбавленных кислот (анионы которых не проявляют окислительных свойств);
4. Каждый металл ряда, не разлагающий воду, вытесняет металлы, имеющие более положительные значения электродных потенциалов из растворов их солей;
5. Чем больше отличаются металлы значениями электродных потенциалов, тем большее значение э.д.с. будет иметь построенный из них гальванический элемент.
Зависимость величины электродного потенциала (Е) от природы металла, активности его ионов в растворе и температуры выражается уравнением Нернста
ЕМе = ЕоМе + RTln(aМеn+)/nF,
где ЕоМе – стандартный электродный потенциал металла, aMen+ – активность ионов металла в растворе. При стандартной температуре 25 оС, для разбавленных растворов заменяя активность (а) концентрацией (с), натуральный логарифм десятичным и подставляя значения R, T и F, получим
ЕМе = ЕоМе + (0,059/n)lgс.
Например, для цинкового электрода, помещенного в раствор своей соли, концентрацию гидратированных ионов Zn2+× mH2O сокращенно обозначим Zn2+ , тогда
ЕZn = ЕоZn + (0,059/n) lg[ Zn2+].
Если [Zn2+] = 1 моль/дм3, то ЕZn = Е оZn.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2252; Нарушение авторских прав?; Мы поможем в написании вашей работы!