
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аналитическое выражение второго закона термодинамики
|
|
|
|
Если изолированная система находится в неравновесном состоянии, то в ней всегда происходят самопроизвольные необратимые процессы, приближающие ее к состоянию равновесия. Как это было показано выше, энтропия всей системы в целом при этом увеличивается, а энергия ее, не изменяясь количественно, деградирует качественно, т.е. работоспособность системы по мере протекания в ней необратимых процессов уменьшается.
В конечном итоге система приходит в состояние равновесия, самопроизвольные необратимые процессы в ней прекращаются, а энтропия перестает увеличиваться, т.е. достигает своего максимума. Это означает, что условия равновесия системы могут быть выражены аналитически условиями максимума ее энтропии, т.е. соотношениями
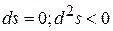 . (5.32)
. (5.32)
В связи с этими соображениями второй закон термодинамики, устанавливающий необратимость и одностороннюю направленность всех самопроизвольных процессов в неравновесных системах может быть сформулирован так: энтропия неизолированной равновесной системы стремится к максимуму, достигая его, когда самопроизвольные процессы в ней прекращаются и система приходит в состояние равновесия.
Эта формулировка показывает, что энтропия системы представляет собой параметр, изменение которого отражает не только качественные, но и количественные ограничения, накладываемые на тепловые процессы вторым законом термодинамики. В наиболее общей форме эти ограничения описываются формулой
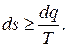 , (5.33)
, (5.33)
которая и является, таким образом, аналитическим выражением второго закона термодинамики.
Применительно к неизолированным системам знак равенства показывает, что все процессы обмена энергией между системой и окружающей средой обратимы, а знак неравенства свидетельствует о наличии и необратимых процессов. Применительно к изолированным системам, для которых dq = 0 и, следовательно, аналитическое выражение второго закона термодинамики принимает вид ds ≥ 0, знак равенства показывает, что в системе необратимые процессы отсутствуют, а знак неравенства свидетельствует о наличии в ней необратимых процессов.
Аналитическому выражению второго закона термодинамики можно придать вид:
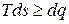 , (5.34)
, (5.34)
а поскольку по первому закону термодинамики
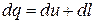 ,
,
любой термодинамический процесс должен удовлетворять соотношению
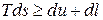 , (5.35)
, (5.35)
которое является, таким образом, объединенным аналитическим выражением первого и второго закона термодинамики. Как ясно из предыдущего, знак равенства относится к обратимым процессам, а знак неравенства – к необратимым.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 10081; Нарушение авторских прав?; Мы поможем в написании вашей работы!