
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия. Многие газообразные тела (с примесью одноименной жидкости в виде взвешенных мелкодисперсных частиц или без нее) принято называть парами
|
|
|
|
Тема №7
Пары и водяной пар
Многие газообразные тела (с примесью одноименной жидкости в виде взвешенных мелкодисперсных частиц или без нее) принято называть парами. В основном это относится к тем веществам, которые мы привыкли встречать преимущественно в жидком виде. Так, например, вода в газообразном состоянии называемся водяным паром, ртуть – ртутным паром, аммиак – аммиачным паром. Вместе с тем некоторые из таких веществ принято относить к газам (например, пропан и бутан).
Такая нечеткость терминологии не меняет существа дела: все пары являются реальными газами и подчиняются всем присущим этим газам закономерностям, в частности закономерностям фазовых переходов.
Образование пара из одноименной жидкости происходит посредством ее испарения или кипения. Между этими двумя процессами существует принципиальное различие.
Испарение жидкости может происходить лишь с открытой поверхности. Сущность его состоит в том, что наиболее подвижные молекулы жидкости, преодолевая действие сил молекулярного притяжения, отрываются от ее поверхности, переходят в свободное пространство и рассеиваются в нем. Такой процесс происходит при любой температуре жидкости и может завершиться полным превращением ее в пар (конечно, если масса жидкости не чересчур велика).
С повышением температуры жидкости процесс испарения ускоряется, поскольку средняя скорость движения молекул возрастает. Однако принципиальный характер его остается прежним, испарение происходит только с наружной поверхности, и лишь по достижении определенных условий происходит качественное изменение всего процесса парообразования – жидкость начинает кипеть.
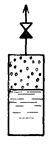 Кипение жидкости может происходить и при отсутствии открытой поверхности. Сущность его состоит в том, что генерация пара происходит в основном в объеме самой жидкости за счет испарения ее внутрь пузырьков пара.
Кипение жидкости может происходить и при отсутствии открытой поверхности. Сущность его состоит в том, что генерация пара происходит в основном в объеме самой жидкости за счет испарения ее внутрь пузырьков пара.
Для выявления основных особенностей процесса парообразования рассмотрим испарение жидкости в ограниченное пространство при постоянном давлении.
 Предположим, что жидкость находится в сосуде достаточно большого объема (рис. 7.1), верхняя часть которого первоначально заполнена сухим воздухом. Постоянство давления в сосуде обеспечивается обратным клапаном, посредством которого свободное пространство сообщается с окружающей средой.
Предположим, что жидкость находится в сосуде достаточно большого объема (рис. 7.1), верхняя часть которого первоначально заполнена сухим воздухом. Постоянство давления в сосуде обеспечивается обратным клапаном, посредством которого свободное пространство сообщается с окружающей средой.
Как было сказано выше, наиболее подвижные молекулы в жидкости отрываются от ее поверхности и переходят в свободное пространство, в котором, следовательно, образуется паровоздушная смесь. Однако вследствие малых размеров свободного пространства часть их опять приближается к поверхности жидкости, попадает в сферу действия сил молекулярного притяжения и возвращается в жидкость. Таким образом, в сосуде одновременно происходят противоположные процессы испарение жидкости и конденсации пара. Пока концентрация молекул пара в паровоздушной смеси мала, первый процесс превалирует над вторым и количество жидкости уменьшается, а количество пара увеличивается. Вместе с этим увеличивается и парциальное давление пара в паровоздушной смеси, парциальное же давление воздуха уменьшается, ибо избыток его удаляется в окружающую среду через обратный клапан и суммарное давление паровоздушной смеси остается неизменным.
С повышением парциального давления пара скорость испарения жидкости уменьшается, а скорость обратной конденсации пара возрастает и в конечном итоге наступает момент, когда скорости обоих процессов становятся одинаковыми. Жидкость и пар приходят в состояние динамического равновесия, при котором видимый массообмен между ними прекращается и в паровоздушной смеси устанавливается постоянное парциальное давление пара.
Пар какого-либо вещества, находящийся в динамическом равновесии с одноименной жидкостью, называется насыщенным паром.
При подогреве жидкости равновесие между ней и насыщенным паром смещается. Средняя скорость молекул с увеличением ее температуры возрастает, поэтому происходит дополнительное парообразование и парциальное давление насыщенного пара в паровоздушной смеси возрастает, а парциальное давление воздуха соответственно уменьшается. Равным образом при охлаждении жидкости равновесие между ней и паром смещается в обратную сторону и парциальное давление насыщенного пара в паровоздушной смеси уменьшается.
Отсюда следует, что температура и давление насыщенного пара взаимосвязаны и каждой температуре соответствует вполне определенное давление насыщения. Так, например, у воды температуре 30°С соответствует давление насыщения около 0,04 бар, температуре 60 °С около 0,2 бар и т. д.
По мере роста температуры паровоздушной смеси содержание воздуха в ней уменьшается за счет вытеснения его паром через обратный клапан. Поэтому в конечном итоге наступает момент, когда из сосуда удаляются последние остатки воздуха и в верхней его части остается один лишь насыщенный пар. Этот момент замечателен тем, что давление насыщенного пара становится равным давлению окружающей среды, под которым все время находилась жидкость, а потому становится возможным кипение жидкости. Легко видеть, что до этого момента оно не могло начаться по той причине, что невозможным было существование пузырьков пара внутри жидкости: общее давление паровоздушной смеси на жидкость было больше давления насыщения, внутри же пузырьков, заполненных чистым паром, давление может быть только равным давлению насыщения. Поэтому пузырьки пара уже в самый момент своего образования были бы сжаты и уничтожены наружным давлением.
Температура, при которой давление насыщения становится равным внешнему давлению на жидкость, называется температурой кипения; она является функцией внешнего давления и с увеличением его возрастает. Так например, для воды при нормальном давлении она равна 100 °С, при давлении 16 бар около 1200°С, при давлении 85 бар около 300 °С и т. д.
После начала кипения в рассматриваемом нами сосуде продолжение подвода тепла сопровождается дальнейшим парообразованием, причем давление в нем сохраняется неизменным, так как излишки пара вытесняются через обратный клапан. Соответственно этому неизменной остается и температура, как пара, так и самой жидкости. Такой процесс продолжается до полного выкипания жидкости, и, в конце концов, наступает момент, когда весь сосуд оказывается заполненным лишь насыщенным паром, температура которого еще равна температуре кипения.
Пар какого-либо вещества, не содержащий в себе одноименной жидкости и имеющий температуру кипения при данном давлении, называется сухим насыщенным паром.
Состояние сухого насыщенного пара является переходным и неустойчивым в тепловом отношении. Всякий дополнительный подвод тепла к нему сопровождается повышением температуры. Кроме того, в сосуде возникает тенденция к повышению давления, поэтому, по мере подвода тепла часть пара удаляется из него через обратный клапан, т.е. удельный объем его увеличивается.
Пар какого-либо вещества, температура, которого превышает температуру кипения при данном давлении, называется перегретым паром.
Как видно из сказанного, в отличие от сухого насыщенного пара, состояние которого определяется значением лишь одного независимого параметра – давления или температуры, состояние перегретого пара определяется значениями двух независимых параметров, в качестве которых наиболее часто используются давление и температура.
С повышением степени перегрева (т.е. разности между температурой перегретого пара и температурой кипения при данном давлении) пар по своим свойствам приближается к идеальному газу.
 При изобарном отводе теплоты от сухого насыщенного пара, который можно представить себе происходящим в цилиндре с подвижным поршнем (рис. 7.2), температура его не изменяется, а вместо этого начинается конденсация пара и по всему его объему образуются мельчайшие капельки жидкости.
При изобарном отводе теплоты от сухого насыщенного пара, который можно представить себе происходящим в цилиндре с подвижным поршнем (рис. 7.2), температура его не изменяется, а вместо этого начинается конденсация пара и по всему его объему образуются мельчайшие капельки жидкости.
 Насыщенный пар какого-либо вещества, содержащий в себе одноименную жидкость в виде взвешенных в нем мелкодисперсных частиц, называется влажным паром.
Насыщенный пар какого-либо вещества, содержащий в себе одноименную жидкость в виде взвешенных в нем мелкодисперсных частиц, называется влажным паром.
Поскольку до полного превращения в жидкость температура влажного пара остается неизменной и не может быть использована для характеристики его состояния, вместо нее применяется другой параметр, специфичный для этого случая – степень сухости х.
Представив себе влажный пар как механическую смесь сухого насыщенного пара и равномерно распределенной в нем жидкости, мы можем определить, степень сухости влажного пара как массовую долю содержащегося в нем сухого насыщенного пара. Очевидно, величина х может изменяться от единицы (что соответствует сухому насыщенному пару) до нуля (что соответствует кипящей воде), т. е. пределы возможных значении х выражаются формулой
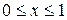 .
.
Таким образом, состояние влажного пара определяется значения двух независимых параметров, которых наиболее часто используются давление и степень сухости.
7.2 Парообразование в  – диаграмме
– диаграмме
Процесс парообразования при постоянном давлении, который можно представить себе происходящим в цилиндре с подвижным поршнем (см. рис. 7.2), в  – диаграмме изображается горизонтальной линией a-b-c-d
– диаграмме изображается горизонтальной линией a-b-c-d 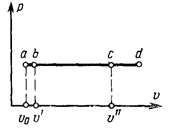 (рис. 7.3), у которой участок a-b соответствует подогреву жидкости от 0°С до температуры кипения, участок b-c – превращению кипящей воды в сухой насыщенный пар и участок с-d – перегреву пара до заданной температуры. Таким образом, на графике величины
(рис. 7.3), у которой участок a-b соответствует подогреву жидкости от 0°С до температуры кипения, участок b-c – превращению кипящей воды в сухой насыщенный пар и участок с-d – перегреву пара до заданной температуры. Таким образом, на графике величины 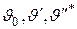 соответствуют удельным
соответствуют удельным  объемам жидкости при 0°С, кипящей жидкости и сухого насыщенного пара.
объемам жидкости при 0°С, кипящей жидкости и сухого насыщенного пара.
При подогреве жидкости удельный объем ее несколько увеличивается вследствие температурного расширения, процесс же парообразования характеризуется резким увеличением удельного объема. Так, например, для воды при нормальном давлении 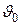 = 0,001м3/кг,
= 0,001м3/кг, 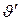 =0,001044 м3/кг,
=0,001044 м3/кг,
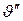 = 1,677 м3/кг, т. е. при подогреве воды от 0°С до температуры кипения (100°С), удельный объем увеличивается всего лишь на 4,4%, а в процессе парообразования более чем в 1600 раз.
= 1,677 м3/кг, т. е. при подогреве воды от 0°С до температуры кипения (100°С), удельный объем увеличивается всего лишь на 4,4%, а в процессе парообразования более чем в 1600 раз.
Построив в 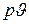 диаграмме аналогичные графики для нескольких различных давлений и соединив одноименные точки плавными линиями (рис. 7.4),
диаграмме аналогичные графики для нескольких различных давлений и соединив одноименные точки плавными линиями (рис. 7.4), 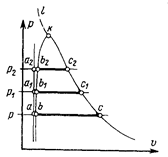 можно заметить, что в связи с очень малой сжимаемостью жидкости линия а – а1 – а2…, выражающая зависимость
можно заметить, что в связи с очень малой сжимаемостью жидкости линия а – а1 – а2…, выражающая зависимость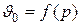 , практически вертикальна; в связи с тем, что при увеличении давления возрастает температура кипения, от которой зависит
, практически вертикальна; в связи с тем, что при увеличении давления возрастает температура кипения, от которой зависит 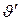 , линия b–b1–b2..., выражающая зависимость
, линия b–b1–b2..., выражающая зависимость 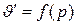 , идет круто вверх с наклоном в правую сторону; наконец, линия c – c1 – c2..., выражающая зависимость
, идет круто вверх с наклоном в правую сторону; наконец, линия c – c1 – c2..., выражающая зависимость 
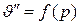 , имеет гиперболический характер. Например, для водяного пара она до давления 20 бар довольно точно описывается уравнением Молье
, имеет гиперболический характер. Например, для водяного пара она до давления 20 бар довольно точно описывается уравнением Молье
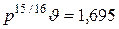 , (7.1)
, (7.1)
где р выражено в барах, а 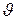 – в кубических метрах на килограмм.
– в кубических метрах на килограмм.
Линия b – b1– b2…, отделяющая область жидкости от области влажного пара и характеризуемая равенством х = 0, называется нижней пограничной кривой; линия c – c1 – c2..., отделяющая область влажного пара от области пара перегретого и характеризуемая равенством х=1, называется верхней пограничной кривой.
С ростом давления разность 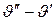 уменьшается и пограничные кривые сближаются, плавно сходясь в критической точке k, где они обе принимают горизонтальное направление.
уменьшается и пограничные кривые сближаются, плавно сходясь в критической точке k, где они обе принимают горизонтальное направление.
Как видно из графика, точка k соответствует некоторому предельному состоянию вещества, при котором исчезает видимое различие между жидкостью и паром. Критические параметры, характеризующие это состояние для каждого вещества, имеют определенные значения. Так, например, для воды ркр=221,15 бар, ркр=374,12°С, ркр= 0,003147 м3/кг.
При сверхкритических давлениях условной границей между жидкостью и перегретым паром служит линия k-l, соответствующая пиковым значениям теплоемкости ср.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 501; Нарушение авторских прав?; Мы поможем в написании вашей работы!