
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимические методы очистки сточных вод
|
|
|
|
Для очистки сточных вод от различных растворимых и диспергированных примесей применяют процессы анодного окисления и катодного восстановления, электрокоагуляции, электрофлотации и электродиализа. Все эти процессы протекают на электродах при пропускании через сточные воды постоянного электрического тока. Электрохимические методы позволяют извлекать из сточной воды ценные продукты при относительно простой автоматизированной технологической схеме очистки, без использования химических реагентов. Основным недостатком этих методов является большой расход электроэнергии. Очистку сточной вод электрохимическими методами можно проводить периодически или непрерывно.
Эффективность электрохимических методов оценивается рядом факторов: плотностью тока, напряжением, коэффициентом полезного использования напряжения, выходом по току, выходом по энергии.
Плотность тока – это отношение силы тока к поверхности электрода, которое обычно выражают в А/м2 (А/см2, А/дм2). Напряжение электролизера складывается из разности электродных потенциалов и падения напряжения в растворе:
u = ea – ek + Dea + Dek + DUэл + Duдиаф,
где Dea и Dek – величина анодной и катодной поляризации; ea и ek –равновесные потенциалы анода и катода; DUэл и Duдиаф – падение напряжения в электролите и диафрагме.
Падение напряжения в электролите (сточной воде) при отсутствии пузырьков газа определяется по закону Ома:
DUэл = i×r×d
где i – плотность тока в сточной воде, А/см2; r - удельное сопротивление, Ом×см; d - расстояние между электродами, см.
При выделении газовых пузырьков, вследствие удлинения потока между электродами, DUэл возрастает. Отношение 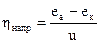 называют коэффициентом полезного использования напряжения.
называют коэффициентом полезного использования напряжения.
Выход по току – это отношение теоретически необходимого количества электричества (находится по закону Фарадея) к практически затраченному, которое выражается в долях единицы или в процентах.
Анодное окисление и катодное восстановление
В электролизере, схема которого показана на рис. *, на положительном электроде – аноде ионы отдают электроны, т.е. протекает реакция электрохимического окисления, на отрицательном электроде – катоде происходит присоединение электронов, т.е. протекает реакция восстановления.
Эти процессы разработаны для очистки сточных вод от растворенных примесей (цианидов, роданидов, аминов, спиртов, альдегидов, нитросоединений, азокрасителей, сульфидов, меркантанов и т.д.). В процессах электрохимического окисления вещества, находящиеся в сточных водах, полностью распадаются с образованием CO2, NH3 и воды или образуются более простые и нетоксичные вещества, которые можно удалить другими методами.
В качестве анодов используют различные электролитические нерастворимые материалы: графит, магнетий, диоксиды свинца, марганца и рутения, которые наносятся на титановую основу. Катоды изготовляют из молибдена, сплава вольфрама с железом или никелем, из графита, нержавеющей стали и др. металлов, покрытых молибденом, вольфрамом или их сплавами.
Процесс проводят в электролизерах с диафрагмой и без нее. Кроме основных процессов электроокисления и восстановления одновременно могут протекать электрофлотация, электрофорез и электрокоагуляция.
Анодное окисление цианидов протекает по реакциям
CN- + 2OH- - 2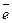 ® CNO- + H2O
® CNO- + H2O
CNO- + 2H2O ® NN4+ + CO32–
Окисление может быть проведено и с образованием азота:
2CNO- + 4OH- - 6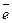 ® 2CO2 + N2 + 2H2O
® 2CO2 + N2 + 2H2O
Катодное восстановление металлов происходит по схеме: (его используют для очистки сточных вод, содержащих трудноокисляемые органические вещества или ионы тяжелых металлов Pb2+, Sn2+, Hg2+, Cu2+, As3+, Cr6+) Меn+ + n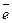 ® Ме0.
® Ме0.
При этом металлы осаждаются на катоде и могут быть рекуперированы.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 560; Нарушение авторских прав?; Мы поможем в написании вашей работы!