
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние скорости охлаждения и наличия примесей на характер кристаллизации
|
|
|
|
Различают два способа образования зародышей: гомогенный и гетерогенный.
С повышением температуры число и размеры кластеров уменьшаются. По мере приближения температуры расплава к точке кристаллизации устойчивость и продолжительность «жизни» их повышается, а при определенной температуре они приобретают полную устойчивость и становятся центрами кристаллизации. Происходит спонтанная кристаллизация, и кристаллы начинают расти на кластерах. Такой тип зарождения кристаллов называется гомогенным.
При гетерогенном образовании зародышей кристаллы растут на инородных зародышах (различных включениях в расплаве).
Для начала кристаллизации необходимо уменьшить свободную энергию, то есть переохладить расплав, отвести некоторое количество теплоты, чтобы на имеющихся зародышах начался рост кристалла.
Зависимость свободной энергии G от температуры, как следует из рис.3.5, различна для жидкой и твердой фаз. При температуре меньше То, более низкую свободную энергию G имеет жидкая фаза, поэтому она будет более устойчивой.
При Тo кривые пересекаются – это температура термодинамического равновесия фаз и в этом случае Gт = Gж, то есть обе фазы обладают одинаковой энергией, достаточной для внешней работы.
Процесс кристаллизации может устойчиво идти при условии Gт < Gж, для чего требуется, чтобы температура кристаллизации (Ткр) была ниже То.
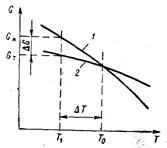
Рис. 3.5. Изменения свободной энергии жидкой Gж и твердой Gт фаз в зависимости от температуры
Разность температур То – Ткр = DТ называется переохлаждением, которое обеспечивает достаточную для начала кристаллизации разность свободных энергий Gж – Gт. За счет разности энергий возмещается работа, необходимая для образования и роста зародышей: А = 32 s3 [ М.То / r q(То – Ткр)]2, где s – поверхностное натяжение на грани растущего кристалла; М – молекулярная масса вещества кристалла; r – плотность вещества кристалла; q – теплота плавления 1 моля вещества кристалла; То –Ткр – степень переохлаждения.
Свободная энергия (энергия Гиббса) определяется соотношением: G = E – TS + pV = H – ST, где Е – внутренняя энергия, S – энтропия (мера разупорядоченности фазы, то есть мера рассеянной энергии); Т – абсолютная температура; р – давление; V – объем; Н – энтальпия.
При температуре равновесной кристаллизации То: Gт = Gж, то есть Нж – SжТо = Нт – SтТо.
Разность энтальпий жидкой и твердой фаз равна теплоте кристаллизации: DН = L = Hж – Тт = (Sж – Sт)То = DSto, то есть L = DSto.
При переохлаждении DТ с выделением теплоты кристаллизации происходит уменьшение объемной свободной энергии (химической составляющей энергии Гиббса): DGV = (Gж – Gт) V, где V – объем.
При образовании сферического зародыша: DGV = -LDT/To*4/3pr3 одновременно происходит повышение объемной и поверхностной энергии (GS) в результате образования поверхности раздела фаз DGS = s4pr2.
Следовательно, процесс кристаллизации протекает в результате изменения общей свободной энергии: DGобщ = DGV + DGS = -LDT / To 4/3 pr3 + s4pr2
После дифференцирования и преобразований находят критический радиус зародыша: rкр = 2sТо / LDT = 2sМто / r q (To – Ткр).
Зарождение кристалла металла на частице примеси возможно только в том случае, если разница в линейных параметрах их кристаллических решеток не будет превышать 15 %.
Чем больше сходство кристаллических решеток металла и подложки, тем раньше (при меньшем переохлаждении) начнется рост металлического кристалла на примеси.
По теории В.И. Данилова, активной примесью может стать частица, имеющая любое кристаллическое строение, и это не противоречит требованиям к подобию кристаллического строения. В тех случаях, когда чужеродная частица находится в длительном контакте с твердым металлом (до расплавления металла в цехе) на границе «металл-примесь» возникает значительная поверхностная энергия из-за различия их кристаллических решеток и случайности взаиморасположения этих решеток. Эта энергия вызывает перемещение поверхностных атомов и в результате на примеси образуется промежуточный слой: на границе с примесью он близок по структуре примеси, а на границе с металлом – близок к структуре металла. В результате частица с отличающейся структурой может стать активной подложкой при кристаллизации. Чем длительнее контакт такой примеси с твердым металлом, тем более вероятно образование устойчивого активного промежуточного слоя.
Однако при расплавлении устойчивость такого слоя снижается, так как исчезновение внешнего твердого слоя металла нарушает равновесие. Поэтому выдержка жидкого металла даже немного выше температуры плавления и особенно более или менее значительный перегрев приводят к дезактивации примеси, то есть к потери способности служить зародышами новой твердой фазы.
Реактивация (восстановление активности) примесей достигается повторным длительным (например, в течение нескольких месяцев) контактом между металлом и примесями в твердом состоянии. Ускорить реактивацию можно нагревом и выдержкой металла, содержащего примеси, при температуре близкой к солидусу.
Подбирать модификаторы с близкими к металлу параметрами кристаллической решетки трудная задача. В связи с этим важно исследование механизма действия активных примесей, а их во всяком реальном расплаве очень много (оксиды, сульфиды, фосфиды, нитриды и др.).
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 564; Нарушение авторских прав?; Мы поможем в написании вашей работы!