
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства элементов I группы главной подгруппы
|
|
|
|
| Свойство | Li | Na | K | Rb | Cs | Fr |
| Заряд ядра | ||||||
| Электронная конфигурация внешнего энергетического уровня в основном состоянии | …2s1 | …3s1 | …4s1 | …5s1 | …6s1 | …7s1 |
| Металлический радиус, пм | ||||||
Энергия ионизации
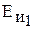 , эВ , эВ
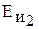 , эВ , эВ
| 5,39 75,6 | 5,14 47,3 | 4,34 31,8 | 4,18 27,5 | 3,89 25,1 | 3,98 – |
| Температура плавления, ºС | – | |||||
| Температура кипения, ºС | – | |||||
| Электроотрицательность: по Полингу по Оллреду-Рохову | 0,98 0,97 | 0,93 1,01 | 0,82 0,91 | 0,82 0,89 | 0,79 0,86 | 0,70 0,86 |
В I группе главной подгруппе сверху вниз металлический радиус увеличивается. Относительно малое увеличение радиуса при переходе от калия к рубидию и к цезию обусловлено заполнением 3d и 4d-подуровней соответственно. Электроны 3d и 4d-подуровней слабо экранируют заряд ядер атомов. Это приводит к сжатию электронных оболочек из-за повышения эффективного заряда ядра.
В I группе главной подгруппе сверху вниз эффективный заряд ядра увеличивается, металлический радиус также увеличивается, энергия ионизации уменьшается, восстановительные свойства атомов возрастают. Единственный электрон на внешнем энергетическом уровне атома щелочного металла слабо связан с ядром, что подтверждается низкими значениями энергии ионизации отрыва первого электрона.
Значения энергии ионизации отрыва второго электрона для всех щелочных металлов высоки, поэтому в реально осуществимых условиях ион Me2+ не образуется, а щелочные металлы проявляют степень окисления +1.
Электроотрицательность щелочных металлов мала. Их соединения с наиболее электроотрицательными элементами (галогениды, нитриды и т.д.) в кристаллическом состоянии являются ионными.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 356; Нарушение авторских прав?; Мы поможем в написании вашей работы!