
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение
|
|
|
|
Все металлы I группы главной подгруппы – сильные восстановители, поэтому их получение требует больших энергетических затрат.
В промышленности литий получают:
Содержание лития в рудах небольшое, поэтому их предварительно обогащают методом флотации. Проводят процесс вскрытия – процесс, с помощью которого добываемые элемент переводят в растворимую или другую удобную для дальнейшей переработки форму.
1. сернокислый метод
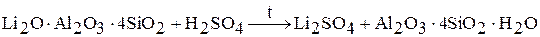
2. известковый метод
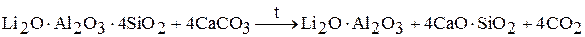
с последующим выщелачиванием водой, при котором происходит взаимодействие алюмината лития с гидроксидом кальция:
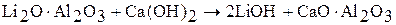
3. сульфатный метод
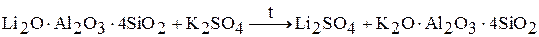
с последующим выщелачиванием и осаждением карбоната:
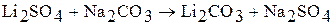
Действием кислоты HCl на карбонат лития его переводят хлорида лития, который впоследствии используют для производства лития.
1. электролизом расплава смеси солей LiCl и KCl (или CaCl2) (анод – графит, катод – железо). Особо чистый литий получают электролизом смеси LiCl – LiBr.
2. восстановлением оксида лития:
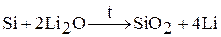
Для данного способа берут не чистые вещества Li2O и Si, а содержащие их материалы (литиевые минералы и сплав ферросилиций). В качестве восстановителя можно использовать алюминий.
Литий хранят под слоем вазелина или парафина в запаянных сосудах (в керосине литий плавает).
В промышленности натрий получают:
1. электролиз расплавов, содержащих хлорид натрия.
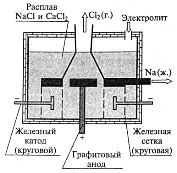
Рис. 1.Промышленное получение металлического натрия
Прим. использовать в качестве сырья чистый NaCl невозможно, потому что разность между температурами плавления NaCl (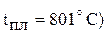 , и натрия (
, и натрия (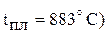 небольшая. К тому же давление насыщенного пара натрия при температуре плавления NaCl близко к атмосферному, что приведет к большой потере натрия вследствие испарения. При высоких температурах нельзя получить натрия без потерь, так как он растворяется в NaCl. Поэтому к хлориду натрия добавляют соль (KCl, NaF, CaCl2 и др.) для понижения температуры плавления шихты ниже 600 ºС. Преимущественно используют расплав, содержащий 40% NaCl и 60% СаСl2 (
небольшая. К тому же давление насыщенного пара натрия при температуре плавления NaCl близко к атмосферному, что приведет к большой потере натрия вследствие испарения. При высоких температурах нельзя получить натрия без потерь, так как он растворяется в NaCl. Поэтому к хлориду натрия добавляют соль (KCl, NaF, CaCl2 и др.) для понижения температуры плавления шихты ниже 600 ºС. Преимущественно используют расплав, содержащий 40% NaCl и 60% СаСl2 (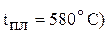 .
.
При электролизе на катоде (железо) выделяется натрий, на аноде (графит) – хлор. Конструкция электролизера (наличие диафрагмы, разделяющей катодное и анодное пространство) исключает возможность взаимодействия образующихся в процессе электролиза хлора и натрия. На производство 1 кг натрия расходуется 10 кВт электроэнергии.
2. электролиз расплава гидроксида натрия. При электролизе на катоде (железо) выделяется металлический натрий, на аноде (никель) протекает реакция:
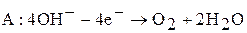
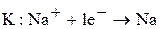
Преимущества метода заключаются в низкой температуре проведения процесса (350 ºС) и возможности получения натрия высокой чистоты. Недостаток данного способа – дорогое сырье.
Натрий хранят в запаянных сосудах или в герметичной железной таре под слоем керосина.
Методы, используемые для производства натрия нельзя применить при производстве калия из-за его высокой реакционной способности при повышенной температуре (его сильной окисляемости кислородом, растворенным в расплаве).
В промышленности калий получают:
1. восстановлением калия из расплавленного гидроксида калия или хлорида калия натрием:
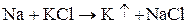
Образуется сплав Na – K, который разделяют перегонкой.
2. электролизом расплава KCl – K2CO3 (катод – жидкий свинец) с последующей отгонкой калия из сплава со свинцом.
3. восстановлением хлорида калия при нагревании в вакууме с алюминием, кремнием, карбидом кальция:
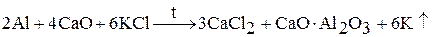
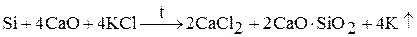
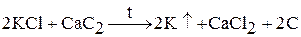
Образующийся щелочной металл уходит из сферы реакции в виде пара, что приводит к смещению химического равновесия вправо.
Калий хранят в запаянных сосудах или в герметичной железной таре под слоем керосина.
В промышленности рубидий и цезий получают:
1. термическим восстановлением соответствующих хлоридов кальцием в вакууме:
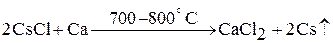
В лаборатории цезий и рубидий получают восстановлением соответствующих соединений цирконием:
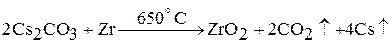
Рубидий и цезий хранят в запаянных стеклянных ампулах.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 7753; Нарушение авторских прав?; Мы поможем в написании вашей работы!