
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поведение щелочных металлов в водном растворе
|
|
|
|
| Li | K | Na | Rb | Cs | |
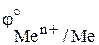 , В , В
| –3,05 | –2,71 | –2,92 | –2,93 | –2,92 |
Самый активный металл – литий.
Электродный потенциал – термодинамическая величина, то 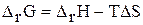 ,
, 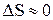 , так как V – const. Поэтому мы можем рассматривать
, так как V – const. Поэтому мы можем рассматривать 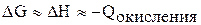 .
.
Рассмотрим тепловой эффект процесса окисления металла, разбив данный процесс на несколько стадий:
1) 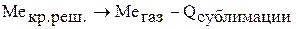
2) 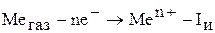
3) Men+ + mH2O ® Men+ × mH2O + Qгидратации
Складываем три процесса (закон Гесса).
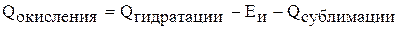
Следовательно, способность металла окисляться в растворе определяется энергией ионизации, прочностью кристаллической решетки, способностью иона металла соединяться с молекулами воды.
Для атомов щелочных металлов характерны малые значения энергии ионизации их атомов. Энергия гидратации (гидратация, в отличии от ионизации протекает с выделением энергии) зависит от радиуса и заряда. Чем больше заряд катиона, тем выше энергия гидратации (ион соединяется с молекулами воды за счет электростатического взаимодействия). Чем больше радиус катиона, тем меньше энергия гидратации.
| Li | Na | K | |
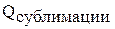
| |||
| Еи | |||
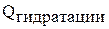
| |||
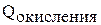
| –159 | –182 | –169 |
Окисления требует затраты энергии, но наименьшая энергия у лития, а потом у калия. У лития идет выигрыш за счет высокой энергии гидратации.
С водой же быстрее реагирует калий, а медленнее – литий.
Относительно низкая активность лития по отношению к воде определяется, прежде всего, кинетическими, а не термодинамическими причинами. Литий наиболее твердый из щелочных металлов и имеет самую высокую температуру плавления, поэтому он медленнее дробится на капли и реагирует спокойнее других щелочных металлов.
4. Щелочные металлы могут восстанавливать другие металлы из их оксидов и галогенидов. Например:
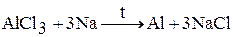
5. Щелочные металлы активно реагируют с растворами кислот, но реакции протекают очень бурно. Например:
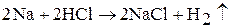
Литий отичается от отсальных щелочных металлов. По ряду свойств литий близок к магнию, чем к щелочным металлам. Например, подобно соответсвующим соединениям магния, малорастворимы в воде фторид лития LiF, карбонат лития Li2CO3, фосфат лития Li3PO4. Гидроксид лития растворим в меньшей степени, чем другие гидроксиды щелочных металлов. Как и магний литий взаимоедйствует с азотом, образуя нитрид лития Li3N.
Кислородсодержащие соединения лития (гидроксид лития, нитрат лития, карбонат лития) при нагревании разлагаются с образованием оксида лития. Например:
4LiNO3 ® 2Li2O + 4NO2 + O2
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1509; Нарушение авторских прав?; Мы поможем в написании вашей работы!