
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гомогенные процессы
|
|
|
|
Лекция 7.
Выбор технологического режима (продолжение Лекции 4).
На основании данных о химической кинетики процесса.
Химическая кинетика – наука изучающая скорость химической реакции.
Под скоростью химической реакции понимают изменение количества вещества j в единицу времени для случая гомогенной реакции в единицу объема, а для гетерогенной реакции на единицу раздела поверхности фаз.
Согласно определению
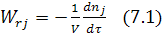 ,
,
Где j – исходный реагент или продукт реакции; dnj – изменение количества вещества; dτ – время; V – объем реакционного пространства.
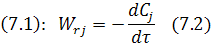
«−» учитывается для исходных реагентов.
«+» учитывается для продуктов реакции.
Рассмотрим реакцию 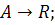
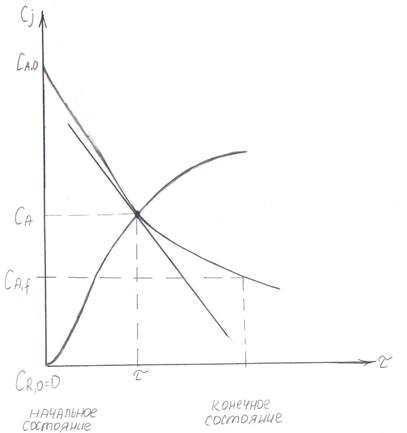
Рис. 7.1 Кинетическая кривая Cj (τ).
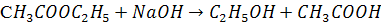
этилацетат щелочь этанол ацетил Na
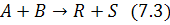
На рис. 7.1 скорость численно равна tan угла наклона касательной, проведенной в точке (τ; CА), и называется мгновенной скоростью.
ССС:
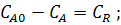
предельное состояние:
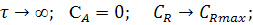
Основные параметры химической реакции:
1) p – порядок реакции.
p= a+b+…
порядок химической реакции численно равен сумме стехиометрических коэффициентов, стоящих перед исходными реагентами.
Если уравнение химической реакции отражает истинный ее механизм протекания, то p только целое число. p также отражает зависимость скорости реакции от концентрации.
Для реакции (7.3): p=2
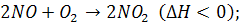
P=3;
A→… P=1
2) Константа скорости химической реакции k отражает зависимость скорости химической реакции от температуры:
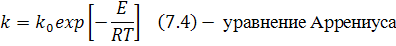
Это количественная оценка влияния температуры на скорость химической реакции.
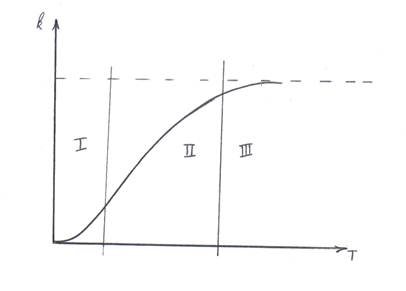
Рис.7.2. Зависимость k от температуры Т.
На кривой можно выделить три участка:
I – ускорение скорости химической реакции;
II – стабилизация скорости химической реакции;
III – замедление скорости химической реакции.
С точки выбора технологического режима в производственных условиях рассматривают II участок. На II участке зависимость у(х) линейная.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 930; Нарушение авторских прав?; Мы поможем в написании вашей работы!