
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод валентных связей
|
|
|
|
В комплексных соединениях
Природа химической связи
Применение метода валентных связей к комплексным соединениям принадлежит Полингу. Полинг показал, что, используя метод валентных связей, можно предсказать геометрическую форму и магнитные свойства комплексов. Теория метода валентных связей объясняет образование комплексов за счёт донорно-акцепторной или координационной связи. Эта связь, как частный случай ковалентной связи, осуществляется между атомом - комплексообразователем, имеющим свободные орбитали и являющимся акцептором электронов, и лигандами, имеющими неподелённые электронные пары, донорами которых они являются. Донором может быть и комплексообразователь. Когда координационная связь образована, она практически ничем не отличается от обычной ковалентной связи.
Например, в комплексном ионе [BF4]- донором электронной пары служит анион фтора, а акцептором - атом бора в молекуле BF3 , обладающий незанятой орбиталью внешнего электронного слоя и переходящий при комплексообразовании в состояние sp3- гибридизации (конфигурация иона – тетраэдр).
Следующие комплексы: [Zn(NH3)4]2+,[Cd(NH3)4]2+, [HgI4]2-
также имеют геометрическую конфигурацию тетраэдра (рис.15):
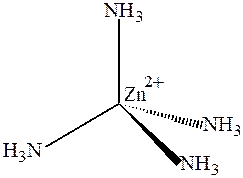
Рис. 15. Структура комплексного катиона [Zn(NH3)4]2+.
Образование этих комплексных ионов можно объяснить тем, что ионы цинка, кадмия и ртути, имея четыре свободных орбитали (Zn2+ - одну 4s и три 4р- орбитали, Cd2+ - одну 5s и три 5р -орбитали, Hg2+ - одну 6s и три 6р-орбитали) могут быть акцепторами электронных пар лигандов, причём осуществляется
sр3 –гибридизация, соответствующая размещению лигандов в вершинах тетраэдра:
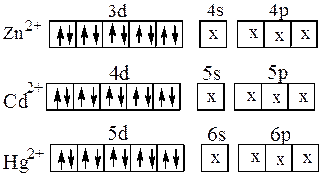
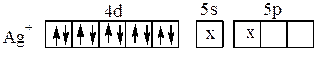
Координационному числу 2 отвечает sp-гибридизация и линейная координация лигандов, как, например, в комплексе
[Ag(NH3)2]+:
Кроме тетраэдрической конфигурации координационному числу 4 соответствует так же квадратная координация лигандов, как, например, в комплексах [Pt(NH3)4]2+, [Pd(NH3)4]2+, [AuCl4]- (рис.16):
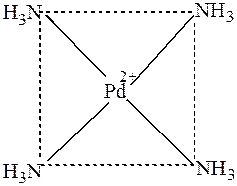
Рис. 16. Структура комплексного катиона [Pd(NH3)4]2+.
Ионы Pt2+,Pd2+,Au3+, имея четыре занятых d –орбитали, предоставляют для электронных пар лигандов одну d, одну s и две р-орбитали. При этом осуществляется гибридизация dsр2:
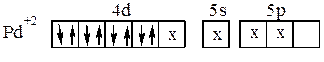
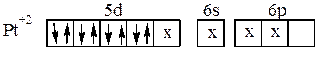
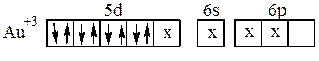
Наиболее распространённым координационным числом является 6, которому соответствует гибридизация d2sp3 или sp3d2 и октаэдрическое расположение лигандов. Такая структура комплекса характерна для Cr3+,Co3+,Pt4+,Fe3+, Fe2+ и многих других.
Например: Cr3+ имеет две свободные 3d –, одну 4s –и три 4р – орбитали, которые они предоставляют для электронных пар лигандов, при этом осуществляется d2sp3- гибридизация. Комплексный ион [Cr(CN)6]3- (рис.17) содержит три неспаренных электрона и, следовательно, парамагнитен:
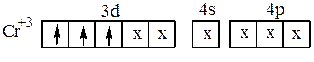
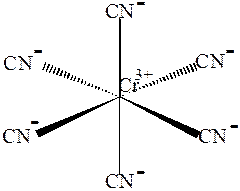
Рис.17. Структура комплексного аниона [Cr(CN)6]3-.
Рассмотрим также два комплексных иона Co3+:
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 4017; Нарушение авторских прав?; Мы поможем в написании вашей работы!