
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Отличие растворов ВМС от коллоидных растворов
|
|
|
|
1. В растворах ВМС частицы - молекулы ВМС, а не мицеллы.
2. У частиц ВМС в растворах иной механизм возникновения заряда: диссоциация собственных ионогенных групп, а не адсорбция из растворов потенциалоопределяющих ионов, добавленных в избытке.
3. У частиц гидрофильных ВМС иной механизм образования водной оболочки: наряду с зарядом частицы водная оболочка образуется за счет гидрофильных групп, расположенных на поверхности частицы.
4. Растворы ВМС термодинамически более устойчивы (D G < 0).
5. Растворы ВМС образуются самопроизвольно (не нужен «стабилизатор»).
6. Растворы ВМС обратимы.
Сходство растворов ВМС с ионно-молекулярными растворами:
1. В растворе ВМС находятся в виде молекул.
2. Термодинамически устойчивы (D G < 0).
3. Образуют гомогенные системы.
4. Образуются самопроизвольно, не требуют «стабилизатора».
Специфические свойства растворов ВМС:
1. Способность к набуханию.
2. Способность к желатинированию.
3. Наличие аномальной вязкости.
4. Свободное вращение отдельных звеньев полимеров с изменением конформации.
При взаимодействии высокомолекулярных систем (ВМС) с растворителем происходит увеличение объема и массы полимера во времени. Этот процесс называется набуханием и характеризуется степенью набухания
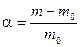 ,
,
где m, m 0 - массы исходной и набухшей высокомолекулярной системы (ВМС).
Набухание может быть ограниченным и неограниченным.
В I случае a достигает постоянного предельного значения (например, желатин и вода). Во II случае значения a и массы проходят через максимум, после чего полимер растворяется (например, желатин и горячая вода). В этом случае набухание является началом растворения. Процесс набухания можно представить происходящим в две стадии:
 1. характерное выделение теплоты набухания и понижение общего объема системы.
1. характерное выделение теплоты набухания и понижение общего объема системы.
2. тепла практически не выделяется, но происходит основное повышение объема.
Причина набухания заключается в различии свойств высокомолекулярной системы (ВМС) и растворителя. Сильное взаимодействие компонентов приводит к постепенному смещению и размыванию границы раздела фаз. Скорость этого процесса определяется подвижностью молекул, коэффициентом их диффузии. Поэтому переход макромолекул в фазу растворителя происходит медленно, тогда как молекулы растворителя быстро проникают в сетку полимера, раздвигают его цепи и увеличивают объем. При этом происходит межмолекулярное взаимодействие, обусловленное главным образом сольватацией макромолекул, поэтому полимер набухает не в любом растворителе, а лишь в подходящем. Для полярных высокомолекулярных систем (ВМС) подходит полярный растворитель, для неполярных - неполярный. Набухание всегда сопровождается возникновением давления набухания, которое может достигать сотни МПа. Давление набухания эквивалентно внешнему давлению, которое нужно приложить, чтобы остановить увеличение объема набухшего вещества. Оно аналогично осмотическому давлению.
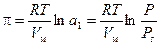
Vм - парциальный мольный объем растворителя.
Уравнение позволяет по давлению пара растворителя рассчитывать давление набухания. Давление набухания сильно понижается с увеличением давления пара растворителя или увеличением степени набухания.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 5158; Нарушение авторских прав?; Мы поможем в написании вашей работы!