
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полиэлектролиты
|
|
|
|
ПЛАСТИФИКАТОРЫ
При набухании молекулы растворителя внедряются между макромолекулами. При этом молекула полимера получает большую подвижность, т.е. гибкость и эластичность за счет снижения сил когезии. Наоборот, при уменьшении количества растворителя в межмолекулярном пространстве увеличиваются силы когезии и возрастает хрупкость систем. Иногда для придания определенных свойств высокомолекулярных систем (ВМС) в межмолекулярное пространство вводят вещества - пластификаторы, выполняющие роль растворителя.
Полиэлектролитами называются ВМС, способные в растворе диссоциировать с образованием высокомолекулярного иона.
В зависимости от природы содержащихся в полимере групп полиэлектролиты можно разделить на три вида:
1) полиэлектролиты, содержащие кислотную группу, например, –СОО- или –ОSOз-;
2) полиэлектролиты, содержащие основную группу, например —NH3+. Такие вещества в природе не встречаются, но могут быть синтезированы;
3) полиэлектролиты, содержащие одновременно как кислотную, так и основную группы (полиамфолиты). Сюда относятся белки, содержащие группы –СОО" и –NН3+.
Все высокомолекулярные электролиты растворяются в полярных растворителях. Важнейшими представителями полиэлектролитов являются белки. Молекулы белков построены на основе аминокислот и содержат основные группы –HONН3 и кислотные группы –СООН:
НОNН3–R–СООH,
где R - длинный углеводородный радикал.
Ионогенные группы могут располагаться не только на концах макромолекулы, но и в виде коротких боковых цепей, распределенных по всей длине макромолекулы.
В кислой среде (НСl) подавлена ионизация карбоксильных групп, белок ведет себя как слабое основание:
HONH3–R–COOH + Н+ ® +NН3–R–СООН + Н2О.
Молекула приобретает положительный заряд. Так как между одноименно заряженными группами, разбросанными по всей длине молекулы, действуют силы отталкивания, цепная молекула белка в кислой среде будет стремиться развернуться.
Однако при большом избытке НС1 из-за наличия большого количества хлорид-ионов степень ионизации соединения СlNН3–R–СООН будет понижаться и молекула снова свернется в более плотный клубок.
В щелочной среде (NаОН) из-за большого количества гидроксид-ионов, ионизация групп НONН3+ – подавлена и белок ведет себя как слабая кислота:
НОNН3–R–СООН + ОН- ® HONН3–R–СОО- + Н2О,
приобретая отрицательный заряд. И в этом случае цепная молекула стремится развернуться вследствие электростатического отталкивания групп СОО-.
При большом избытке щелочи из-за большого количества ионов Na+ заряд будет уменьшаться и молекула будет находиться в форме клубка.
Таким образом, как в кислой, так и в щелочной среде молекулы белка обладают нескомпенсированным зарядом разного знака. Регулируя рН белкового раствора, можно добиться перевода белка в изоэлектрическое состояние.
Изоэлектрическим состоянием белка называется состояние белковой молекулы, при котором ее положительные и отрицательные заряды взаимно скомпенсированы. Молекулу белка в изоэлектрическом состоянии можно считать нейтральной, хотя в ней имеются ионизированные группы.
Условно молекулу белка в изоэлектрическом состоянии можно изобразить так: +NН3–R–СОО-.
Изоэлектрическая точка белка (ИТБ) – это значение рН, при котором белок переходит в изоэлектрическое состояние.
Так как белок обычно является более сильной кислотой, чем основанием, его ИТБ лежит при рН < 7. Т.е. для достижения изоэлектрического состояния в растворе должен находиться некоторый избыток кислоты, для подавления ионизации кислотных групп. Так как в ИТБ число ионизированных основных и кислотных групп одинаково, гибкая макромолекула сворачивается в клубок.
На форму макромолекул влияет не только рН среды, но и введение в раствор индифферентного электролита. Небольшое количество электролита подавляет ионизацию ионогенных групп и приводит к наиболее статистически вероятным конформациям. При больших концентрациях электролитов происходит высаливание вследствие уменьшения растворимости полимера – макромолекулы образуют плотные клубки. Действие ионов на полиэлектролиты изменяется в том порядке, в котором они стоят в лиотропном ряду.
Мембранное равновесие Доннана показывает, как распределяется электролит по обе стороны полупроницаемой мембраны.
1. До начала распределения
По одну сторону мембраны: По другую сторону мембраны:
R-Na- ионогенный ВМС NaCl
[R-]=C1 [Na+]=C2
[Na+]=C1 [Cl-]=C2
Ионов хлора совсем нет по ту сторону мембраны, поэтому они переходят в клетку из внеклеточного пространства, а вместе с ними в клетку переходит часть ионов натрия.
2. Обозначим количество веществ, перешедших в клетку X, тогда после перераспределения электролита:
в клетке: вне клетки:
[R-]=C1 [Na+]=C2-Х
[Na+]=C1+Х
[Cl-]=Х [Cl-]=C2-Х
Переход ионов электролита осуществляется до тех пор, пока установится ионное равновесие, т. е. произведения концентраций ионов по обе стороны мембраны должны быть равны:
[Na+] кл. х [Cl-] кл. = [Na+] вне кл. х [Cl-] вне кл.
(С1 + Х)×Х=(С2 - Х)×(С2 - Х)
откуда 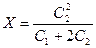 - это уравнение мембранного равновесия Доннана.
- это уравнение мембранного равновесия Доннана.
Анализ мембранного равновесия Доннана
1. Если в клетке нет белка и его соли, то С1 = 0, тогда 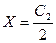 , т. е. при отсутствии в клетке ВМС электролит распределяется поровну по обе стороны мембраны.
, т. е. при отсутствии в клетке ВМС электролит распределяется поровну по обе стороны мембраны.
2. Если в клетке концентрация белка (и его соли) равна концентрата электролита вне клетки, т. е. С 1 = С 2, тогда 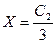 , т.е. в клетку из внеклеточной жидкости перейдет 1/3 часть электролита.
, т.е. в клетку из внеклеточной жидкости перейдет 1/3 часть электролита.
3. Если в клетке большая концентрация белка (и его соли), т. е, С1 >> С2, то все равно величинаХ - положительная, так как С22 и в клетку перейдет небольшое количество электролита из внеклеточной жидкости.
4. Если концентрация белка (и его соли) в клетке невелика, а концентрацияэлектролита вне клетки большая, т. е. если С2 > C2, то С22 - величина очень большая и X — величина большая. В клетку в этом случае перейдет большая часть электролита.
Т.е., в клетке при наличии ВМС концентрация электролита всегда больше, чем во внеклеточной жидкости, что обусловливает повышенное осмотическое давление в клетке, тургор клеток и тканей.
ПАВ
· Образование этих систем самопроизвольно, часто с выделением энергии;
· Имеется сильное межмолекулярное взаимодействие между частицами фазы и среды, межфазовое натяжение мало, межфазовая граница размыта;
· Системы термодинамически устойчивы – постоянство во времени концентрации и размеров частиц.
 ПАВ – вещества, добавление которых в гетерогенную систему уменьшает поверхностное натяжение на границе раздела фаз, причем во всем интервале концентраций вплоть до насыщенного раствора ПАВ находятся в молекулярно-дисперсном состоянии (системы гомогенные). Обозначение
ПАВ – вещества, добавление которых в гетерогенную систему уменьшает поверхностное натяжение на границе раздела фаз, причем во всем интервале концентраций вплоть до насыщенного раствора ПАВ находятся в молекулярно-дисперсном состоянии (системы гомогенные). Обозначение
При удлинении углеводородной цепи до 8-10 атомов углерода молекулы ПАВ становятся способны объединяться в агрегаты, содержащие десятки молекул и называемые мицеллами. При малых концентрациях ПАВ образуют истинные растворы. При увеличении концентрации раствора до величины, именуемой критической концентрацией мицеллообразования (ККМ), в растворе появляется новая фаза. Такие системы обладают свойствами коллоидных растворов.
Различие коллоидных ПАВ и обычных – в длине углеводородного радикала.
Классификация ПАВ
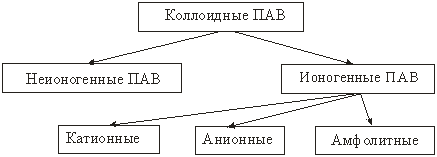
Анионные ПАВ (диссоциирующие в воде с образованием поверхностно-активного аниона):
а) карбоновые кислоты (RCOOH), их соли (RCOOM);
|
в) алкиларилсульфонаты RArSO2OM;
г) фосфаты, тиосульфаты.
Катионные ПАВ (диссоциирующие в воде с образованием ПАкатиона):
а) соли первичных, вторичных, третичных алифатических и ароматических аминов;
б) соли алкилзамещенных аммониевых оснований;
в) пиридиновые соединения.
Амфолитные ПАВ – содержащие две функциональные группы, одна из которых имеет кислый характер, другая – основной. В зависимости от среды соединение диссоциирует как кислота и как основание:
RNH(CH2)nCOO- ↔ RNH(CH2)nCOOH ↔ RNH2(CH2+)nCOOH
Анионоактивные св-ва Катионоактивные св-ва
Неионогенные ПАВ – в растворах не распадаются на ионы, соединения, полученные на основе оксида этилена путем присоединения его к спиртам, карбкислотам, аминам и т.д.:
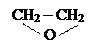 ROH+ n → RO(OCH2CH2)nH
ROH+ n → RO(OCH2CH2)nH
 |
Полиоксиэтиленовая цепь
Полиоксиэтиленовая цепь определяет гидрофильные свойства неионогенных ПАВ.
Свойства водных растворов ПАВ
1. Способность снижать s на границе раздела фаз;
2. Способность к самопроизвольному мицеллообразованию;
3. Солюбилизация.
1. Обусловлена высокой поверхностной активностью ПАВ: 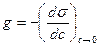 , которая возрастает с увеличением длины углеводородного радикала – правило Дюкло-Траубе: увеличение длины углеводородного радикала на одну группу –СН2– приводит к возрастанию поверхностной активности в 3 – 3,5 раза. При большой длине углеводородных радикалов (заметно взаимодействие между молекулами ПАВ на поверхности) g увеличивается медленнее, чем по правилу Дюкло-Траубе. Поверхностную активность коллоидных ПАВ приближенно оценивают так:
, которая возрастает с увеличением длины углеводородного радикала – правило Дюкло-Траубе: увеличение длины углеводородного радикала на одну группу –СН2– приводит к возрастанию поверхностной активности в 3 – 3,5 раза. При большой длине углеводородных радикалов (заметно взаимодействие между молекулами ПАВ на поверхности) g увеличивается медленнее, чем по правилу Дюкло-Траубе. Поверхностную активность коллоидных ПАВ приближенно оценивают так:
Для неионогенных ПАВ: 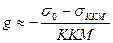 ;
;
Для ионогенных ПАВ: 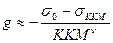 , где s0 – поверхностное натяжение воды, sККМ - поверхностное натяжение р-ра ПАВ при ККМ, ККМ – критическая концентрация мицеллообразования ПАВ, n - число ионов, образующихся при диссоциации одной молекулы ПАВ.
, где s0 – поверхностное натяжение воды, sККМ - поверхностное натяжение р-ра ПАВ при ККМ, ККМ – критическая концентрация мицеллообразования ПАВ, n - число ионов, образующихся при диссоциации одной молекулы ПАВ.
Адсорбционная способность ПАВ тем выше, чем больше g. Адсорбируясь на частицах дисперсной фазы, молекулы ПАВ создают на их поверхности защитные адсорбционно-сольватные оболочки, препятствующие слипанию частиц дисперсной фазы:
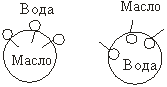
Важная количественная характеристика ПАВ – гидрофильно-липофильный баланс (ГЛБ), характеризующий соотношение между гидрофильными и липофильными свойствами: чем выше число ГЛБ, тем более баланс сдвинут в сторону полярных (гидрофильных свойств). Определяется экспериментально. Числа ГЛБ рассчитываются по уравнению:
ГЛБПАВ = 7 + S(ГЛБ)Г - S(ГЛБ)Л
| Сумма чисел ГЛБ всех гидрофильных групп | Сумма чисел ГЛБ всех липофильных групп |
Физический смысл чисел ГЛБ – отношение работы адсорбции молекул ПАВ на границе раздела фазы «масло» к работе адсорбции на той же границе с фазой «вода».
2. По достижении в растворе ККМ самопроизвольно образуются сферические мицеллы (мицеллы Гартли), система становится гетерогенной. Мицелла коллоидного ПАВ – ассоциат дифильных молекул, лиофильные группы которого обращены к растворителю (вода), а лиофобные соединяются друг с другом, образуя ядро (дать рисунок).
 Вопрос – почему мицеллообразование происходит самопроизвольно, если известно, что образование новой фазы требует затраты энергии? Так как s на границе раздела фаз минимально, энергия, затрачиваемая на образование мицеллы, невелика, и она с избытком компенсируется выигрышем энергии за счет выведения углеводородных хвостов молекул ПАВ в ядро мицеллы (жидкий углеводород в результате плотной упаковки углеводородных цепей), т.е. в итоге мицеллообразование сопровождается уменьшением свободной энергии системы.
Вопрос – почему мицеллообразование происходит самопроизвольно, если известно, что образование новой фазы требует затраты энергии? Так как s на границе раздела фаз минимально, энергия, затрачиваемая на образование мицеллы, невелика, и она с избытком компенсируется выигрышем энергии за счет выведения углеводородных хвостов молекул ПАВ в ядро мицеллы (жидкий углеводород в результате плотной упаковки углеводородных цепей), т.е. в итоге мицеллообразование сопровождается уменьшением свободной энергии системы.
Число молекул ПАВ, составляющих мицеллу, называется числом ассоциации n. Для ионогенных ПАВ n увеличивается при понижении температуры и добавлении электролитов.
Для неионогенных ПАВ повышение температуры приводит к увеличению n, а введение электролитов на число ассоциации не влияет.
Сумма молекулярных масс всех молекул в мицелле называется мицеллярной массой. По достижении определенной концентрации сферические мицеллы начинают взаимодействовать между собой, что приводит к их деформации. Этапы изменения форм мицелл можно представить так:
 Молекулярный р-р ↔ Мицеллы Гартли ↔ Цилиндрические ↔ Дискообразные ↔ Пластинчатые
Молекулярный р-р ↔ Мицеллы Гартли ↔ Цилиндрические ↔ Дискообразные ↔ Пластинчатые
Мицеллы Мак-Бена
↔ Жидкокристаллическая структура ↔ Гелеобразная структура ↔ Твердое кристаллическое ПАВ
3. Солюбилизация – явление растворения веществ в мицеллах ПАВ, это процесс самопроизвольный и обратимый.
В водных мицеллярных растворах солюбилизируются вещества, нерастворимые в воде – бензол, жиры, органические красители, т.к. ядро мицеллы проявляет свойства неполярной жидкости.
Солюбилизат – вещество, солюбилизированное раствором ПАВ.
Солюбилизатор – ПАВ, солюбилизирующее неполярное вещество.
Способ включения молекул солюбилизата в мицеллы зависит от природы вещества: неполярные углеводороды располагаются в ядрах мицелл, полярные органические вещества (спирты, амины, кислоты) встраиваются в мицеллу так, чтобы их полярные группы были обращены к воде, а липофильные части молекул ориентированы параллельно углеводородным радикалам ПАВ.
Для неионогенных ПАВ характерен еще один способ включения солюбилизата в мицеллы: молекулы солюбилизата не проникают внутрь мицеллы, а закрепляются на их поверхности, располагаясь между полиоксиэтиленовыми цепями.
При солюбилизации неполярных углеводородов в ядрах мицелл размер мицелл увеличивается. Солюбилизация в водных растворах ПАВ обычно увеличивается с повышением гидрофобности ПАВ и гидрофильности солюбилизата.
Явление солюбилизации очень широко используется в различных процессах с использованием ПАВ:
· Эмульсионная коагуляция;
· Получение эмульсионных смазочных жидкостей:
· Изготовление фармпрепаратов;
· Изготовление пищевых продуктов.
На величину ККМ влияют:
1. Строение и длина углеводородной цепи;
2. Характер полярной группы;
3. Наличие в растворе индифферентных электролитов и неэлектролитов;
4. Температура.
1-2. Влияние первых двух факторов отражает формула 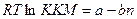 , где а – постоянная, характеризующая энергию растворения полярной группы; b – постоянная, характеризующая удельную энергию растворения, приходящуюся на группу –СН2-; n число групп –СН2-. Т.е., чем больше энергия растворения гидрофобной группы, чем больше их число, тем меньше ККМ, тем легче образуется мицелла. Чем больше энергия растворения полярной группы, роль которой в удержании образующихся ассоциатов в воде, тем больше ККМ.
, где а – постоянная, характеризующая энергию растворения полярной группы; b – постоянная, характеризующая удельную энергию растворения, приходящуюся на группу –СН2-; n число групп –СН2-. Т.е., чем больше энергия растворения гидрофобной группы, чем больше их число, тем меньше ККМ, тем легче образуется мицелла. Чем больше энергия растворения полярной группы, роль которой в удержании образующихся ассоциатов в воде, тем больше ККМ.
Гидратация противоионов, окружающих мицеллу, способствует отталкиванию, а менее гидратированные ионы легче адсорбируются на поверхности мицелл, в связи с чем наблюдается уменьшение ККМ и увеличение мицеллярной массы для катионных ПАВ в ряду Cl- < Br- < I- и анионных в ряду Na+ < K+ < Cs+. Мицеллообразование затрудняется с увеличением заряда ионогенной группы.
Величина ККМ ионогенных ПАВ значительно больше, чем неионогенных при одинаковой гидрофобности молекул.
Введение электролитов в водные растворы неионогенных ПАВ мало влияет на величину ККМ и размеры мицеллы.
Введение электролитов в водные растворы ионогенных ПАВ оказывает значительное влияние, которое оценивается уравнением: 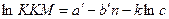 , где а’ и b’ – постоянные, имеющие тот же физический смысл, что и а и b, k – константа; с – концентрация индифферентного электролита. Т.е. увеличение концентрации индифферентного электролита уменьшает ККМ – следует из уравнения.
, где а’ и b’ – постоянные, имеющие тот же физический смысл, что и а и b, k – константа; с – концентрация индифферентного электролита. Т.е. увеличение концентрации индифферентного электролита уменьшает ККМ – следует из уравнения.
Введение неэлектролитов (органических растворителей) в водные растворы ПАВ тоже приводит к изменению ККМ. При наличии солюбилизации устойчивость мицелл повышается, т.е. уменьшается ККМ. При отсутствии солюбилизации (молекулы неэлектролита внутрь мицеллы не входят), как правило, ККМ увеличивается.
Влияние температуры на ККМ ионогенных ПАВ и неионогенных различно. Повышение температуры приводит к увеличению ККМ ионогенного ПАВ из-за дезагрегирующего действия теплового движения. Повышение температуры приводит к уменьшению ККМ неионогенного ПАВ за счет дегидратации оксиэтиленовых цепочек.
Температура начала коллоидной растворимости ПАВ была названа точкой Крафта (ТКр). На фазовой диаграмме раствора ПАВ в районе точки Крафта кривая растворимости ПАВ, которая разграничивает область существования кристаллогидратов ПАВ (а) с мицеллярной областью (в) и областью истинного раствора (с) (ПАВ находится в молекулярно-дисперсном, ионизированном состоянии). Точка Крафта интерпретируется как тройная точка на диаграмме состояния ПАВ, в которой сосуществуют в равновесии мицеллы, ионы и кристаллы ПАВ.
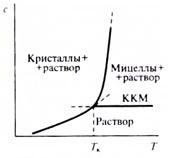 Величина точки Крафта зависит от молекулярного строения ПАВ, природы и концентрации добавок. Изменения структуры ПАВ, приводящие к усилению межмолекулярного притяжения в углеводородных областях, вызывают ее повышение. Так, величина ТКр повышается в гомологических рядах ПАВ по мере роста длины углеводородного радикала.
Величина точки Крафта зависит от молекулярного строения ПАВ, природы и концентрации добавок. Изменения структуры ПАВ, приводящие к усилению межмолекулярного притяжения в углеводородных областях, вызывают ее повышение. Так, величина ТКр повышается в гомологических рядах ПАВ по мере роста длины углеводородного радикала.
Суспензии
Это системы Т/Ж, можно охарактеризовать как взвеси порошков в жидкостях. Формально от коллоидных растворов – лиозолей – отличаются только размером дисперсной фазы (размеры твердых частиц на несколько порядков больше). Поэтому целесообразно сопоставлять свойства конкретных суспензий со свойствами коллоидных растворов.
1. Классификация суспензий
| По природе дисперсионной среды | 1. Органосуспензии (среда – органическая) |
| 2. Водные суспензии | |
| По размерам частиц дисперсной фазы | 1. Грубые – 10-2 > d > 10-4 м |
| 2. Тонкие – 5×10-7 < d < 10-4 м | |
| 3. Мути - 10-7 < d < 5×10-7 м | |
| По концентрации частиц дисперсной фазы | 1. Разбавленные (взвеси) – свободнодисперсные системы |
| 2. Концентрированные (пасты) – связнодисперсные структурированные системы |
2. Методы получение суспензий
| Диспергирование | Конденсация |
| Способы получения суспензий | |
| 1. Взбалтывание порошка в жидкости (разбавленные суспензии) | 1. Коагуляция лиозолей |
| 2. Растирание с небольшим количеством жидкости (концентрированные) |
Очистка суспензий от примесей может осуществляться диализом, электродиализом, фильтрованием, центрифугированием.
3. Свойства
| Оптические | Длины волн видимой части спектра лежат в интервале 400 < l < 700 нм (фиолетовый – красный). Грубые и тонкие суспензии – поглощение и отражение, мути – рассеяние |
| Электрокинетические | Обусловлены образованием ДЭС на поверхности частицы и возникновением электропотенциала. Проявляются все 4 вида электрокинетических явлений. |
| Молекулярно-кинетические | Грубые – броуновское движение отсутствует, быстрая седиментация |
| Тонкие – седиментационно-диффузионное равновесие (гипсометрический закон) | |
| Мути – диффузия преобладает над седиментацией |
4. Устойчивость
| Вид устойчивости | Размер частиц фазы | Реализуемость свойства |
| Седиментационная | Грубые | Неустойчивы |
| Тонкие | Устойчивы | |
| Мути | Устойчивы |
Седиментационная устойчивость – способность сохранять неизменным во времени распределение частиц по объему системы (противостоять действию силы тяжести).
Большинство суспензий – полидисперсны, содержат и относительно крупные частицы, не участвующие в броуновском движении, поэтому седиментационно (кинетически) суспензии неустойчивы. При rфазы > rсреды – оседание, при rфазы < rсреды – всплывание.
Изучают седиментацию, строя кривые накопления осадка 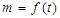 . Кривые двух видов – с перегибом и без него. Вид кривых зависит от агрегативной устойчивости суспензий: если седиментация сопровождается укрупнением частиц, и, Þ увеличением скорости их оседания, то на кривой седиментации появляется точка перегиба. Если же суспензия агрегативно устойчива, перегибов нет.
. Кривые двух видов – с перегибом и без него. Вид кривых зависит от агрегативной устойчивости суспензий: если седиментация сопровождается укрупнением частиц, и, Þ увеличением скорости их оседания, то на кривой седиментации появляется точка перегиба. Если же суспензия агрегативно устойчива, перегибов нет.
В агрегативно устойчивых суспензиях оседание частиц медленное, формируется очень плотный осадок: поверхностные слои препятствуют агрегированию частиц, скользя друг по другу, частицы переходят в положение с минимальной потенциальной энергией (образованием плотной упаковки). Расстояние между частицами и координационное число (число соседних частиц) в осадке такой суспензии определяется соотношением между силой тяжести, межмолекулярным притяжением частиц и силами отталкивания.
В агрегативно неустойчивых суспензиях оседание частиц быстрее из-за образования агрегатов, но осадок занимает гораздо больший объем вследствие случайности взаиморасположения при первом контакте, силы сцепления соизмеримы с их силой тяжести или больше ее. Наблюдается преобладание одного из размеров частиц над двумя другими – анизометрия образующихся агрегатов или флокул.
Если частицы имеют средние размеры, различие седиментационных объемов агрегативно устойчивых и неустойчивых систем проявляется четко. Если частицы крупные, то, несмотря на агрегативную неустойчивость, осадок более плотный из-за значительной силы тяжести, преобладающей над силами сцепления между частицами. Если частицы мелкие, то и в агрегативно устойчивой системе из-за малой силы тяжести образуется очень подвижный осадок.
| Вид устойчивости | Влияющие факторы | Условия устойчивости | |
| Агрегативная | Плотность поверхностного заряда частиц | 1. Смачиваемость поверхности частиц дисперсионной средой | |
| Потенциал Штерна | 2. Наличие стабилизатора | ||
| Толщина ДЭС | Низкомол. электролиты | Коллоидные ПАВ | ВМС |
| Лиофильность суспензии |
Агрегативная устойчивость – способность сохранять неизменной во времени степень дисперсности. Агрегативная устойчивость разбавленных суспензий сходна с устойчивостью лиофобных золей, но суспензии более устойчивы (содержание более крупных частиц обусловливает меньшую свободную поверхностную энергию). При нарушении агрегативной устойчивости суспензии происходит коагуляция – слипание частиц дисперсной фазы – аналогично происходящему в лиозолях, коагуляция лиозолей приводит к образованию суспензий и даже осадка..
Для обеспечения агрегативной устойчивости суспензии необходимо выполнение хотя бы одного из условий:
· Смачиваемость поверхности частицы дисперсной фазы дисперсионной средой;
· Наличие стабилизатора.
При хорошей смачиваемости частицы дисперсионной средой на поверхности частицы образуется сольватная оболочка, обладающая упругими свойствами и препятствующая соединению частиц в крупные агрегаты. Хорошей смачиваемостью обладают полярные частицы в полярной среде и неполярные частицы в неполярной соответственно. Пример агрегативно устойчивых суспензий без стабилизатора с сольватационным механизмом устойчивости – суспензия кварца в воде, сажа в бензоле.
При несмачивании частиц дисперсионной средой используют стабилизатор – вещество, добавление которого в дисперсную систему повышает ее агрегативную устойчивость.
Механизмы стабилизирующего действия различны в зависимости от природы стабилизатора. Напомню возможные факторы устойчивости: адсорбционно-сольватный, электростатический, структурно-механический, энтропийный, гидродинамический.
Если стабилизатор – ионогенное вещество, то имеет место электростатический фактор устойчивости: на поверхности частиц образуется ДЭС, возникает электрокинетический потенциал и электростатические силы отталкивания, препятствующие слипанию частиц (теория ДЛФО). Если это ионогенное вещество – низкомолекулярный неорганический растворитель, то его стабилизирующее действие ограничено только этим фактором. Если же это коллоидное ПАВ или полиэлектролит, то реализуются и другие факторы устойчивости.
Стабилизация ПАВ
Стабилизирующее действие определяется способностью адсорбироваться на поверхности, образуя адсорбционные пленки. Строение адсорбционного слоя зависит от природы ПАВ, природы межфазной поверхности, степени заполнения поверхности, наличия в среде различных добавок. Коллоидное ПАВ, обладая дифильным строением, способно адсорбироваться как на полярных, так и на неполярных поверхностях. Стабилизирующее действие ПАВ в соответствии с правилом уравнивания полярностей Ребиндера проявляется тем заметнее, чем больше первоначальная разница в полярностях твердой частицы и жидкой среды Þ реализуется адсорбционно-сольватный фактор устойчивости. Лучший стабилизирующий эффект достигается при более специфическом подборе ПАВ, сходном с подбором ПАВ для стабилизации прямых и обратных эмульсий. Так, для стабилизации суспензии полярных частиц в неполярной жидкости, используют коллоидное ПАВ со значениями ГЛБ=3¸6, для неполярных частиц в полярной жидкости – ГЛБ=8¸13.
Стабилизация ВМС и полиэлектролитов
В этом качестве можно использовать только ВМС, являющиеся одновременно и ПАВ (ПАВМС). Для оказания защитного действия молекулы полимера должны адсорбироваться на поверхности частицы, т.е. только в случае уменьшения поверхностного натяжения на границе раздела фаз. Для этих веществ характерно возникновение структурно-механического фактора устойчивости. Т.обр., механизм стабилизирующего действия ВМС подобен механизму «коллоидной защиты» - адсорбция полимера на частицах приводит к возникновению защитной оболочки, обладающей механической прочностью и упругостью, причем адсорбция ВМС необратима. Структурно-механический фактор устойчивости суспензий обычно сопровождается энтропийным фактором, т.к. при сближении частиц, стабилизированных ВМС, уменьшается число возможных конформаций молекул полимера Þ уменьшается энтропия системы, поэтому частицы стремятся оттолкнуться друг от друга. При использовании в качестве ВМС полиэлектролитов к двум факторам добавляется третий – электростатический. Полиэлектролиты-стабилизаторы применяются для водных суспензий (для стабилизации гидрофобных частиц в полярных жидкостях), представители – белки, карбоксиметилцеллюлоза и т.д.
Сенсибилизация
Это явление уменьшения агрегативной устойчивости суспензий при добавлении к ней ВМС. Обнаруживается при малом содержании макромолекул в дисперсионной среде и объясняется образованием между отдельными частицами мостиков стабилизатора. Решающее влияние на защитное действие макромолекул оказывает соотношение между количеством полимера и удельной поверхностью частицы.
Агрегативная устойчивость суспензий зависит от специфического взаимодействия макромолекул с поверхностью частиц фазы Þ выбор ВМС для стабидизации суспензий носит эмпирический характер.
5. Методы разрушения суспензий
| Механические | Термические | Химические | Электрические | |
| Основаны на отделении дисперсной фазы от среды | Замораживание с после-дующим оттаиванием | Высушивание (концентрирование) | (Реагентные) – понижающие агрегативную устойчивость | Создание разности потенциалов, приводящей к движению заряженных частиц и осаждению их на электроде |
Механические методы предполагают использование устройств: отстойников, фильтров, центрифуг. Эти методы используются на завершающем этапе, когда агрегативная устойчивость суспензий снижена или отсутствует.
Термические методы требуют больших энергозатрат, как правило, в промышленных масштабах не используются.
Химическое действие направлено на уничтожение потенциального барьера коагуляции, для чего подбирают необходимые химические реагенты. Предварительно выясняют главный фактор устойчивости.
Если главный фактор устойчивости – электростатический, т.е. обусловлен наличием ДЭС на поверхности частицы и x-потенциала (суспензия стабилизирована низкомолекулярным неорганическим электролитом), используют реагенты, понижающие x-потенциал до 0 - индифферентные электролиты.
Если фактор - адсорбционно-сольватный и стабилизатор - коллоидное ПАВ, то действуют в двух направлениях:
1. Меняют химическую природу стабилизатора (растворимое соединение перевести в нерастворимое):
2C17H33COONa + CaCl2 = (C17H33COO)2Ca + 2NaCl
олеат натрия олеат кальция
2.Не меняя природы стабилизатора, меняют строение адсорбционного слоя (уменьшить смачиваемость частицы средой, образуя второй слой молекул ПАВ, противоположно ориентированных)
При стабилизации суспензии амфолитным полиэлектролитом эффективно приближение рН-среды к его изоэлектрической точке.
Если в исходной суспензии присутствуют только отрицательно заряженные частицы фазы, эффективно добавление солей Al или Fe, образующих в результате гидролиза положительно заряженные золи гидроксидов алюминия и вызывающих взаимную коагуляцию отрицательных частиц суспензии.
Сенсибилизация – эффективный метод снижения агрегативной устойчивости. Используют флокулянты – линейные полимеры с полярными группами на обоих концах цепи, молекула полимера скрепляет две разные частицы фазы, образуя рыхлый хлопьевидный осадок.
Электрические методы разрушения используются, когда частицы в суспензиях имеют заряд, т.е. стабилизированы ионогенными веществами. Требуют больших энергетических затрат и специального оборудования, обычно не используются для разрушения больших объемов суспензии.
ПАСТЫ
Это высококонцентрированные суспензии, обладающие структурой (пространственной сеткой из частиц дисперсной фазы, в петлях которой находится дисперсионная среда).
2. Методы получения паст
| Из порошков | Растиранием порошков в жидкости с большой вязкостью |
| Из разбавленной суспензии | Седиментацией разбавленной суспензии |
3. Структурообразование в пастах
Возможность структурообразования определяется балансом сил тяжести частиц и сцепления с соседними частицами. Преобладание сил сцепления обеспечивает более прочную структуру.
Факторы, влияющие на структурообразование
| Агрегативная устойчивость разбавленной суспензии | Агрегативно устойчивые – в результате седиментации образуется компактный осадок с плотной упаковкой частиц, структуры нет или очень непрочная (межчастичные связи отсутствуют) |
| Агрегативно неустойчивые – по мере снижения устойчивости нарастают межчастичные взаимодействия, возникает и упрочняется структура | |
| Концентрация частиц дисперсной фазы | Концентрационный интервал делится на 3 части: Малые конц-ции: I - бесструктурная суспензия; Средние конц-ции (£ККструкттурообр-я): II - появление отдельных структурных элементов (структурированная жидкообразная система); Большие конц-ции (³ККструктурообр-я): III - возникает и развивается структура (Р Т > 0) – структурированная твердообразная система. |
| Размеры частиц дисперсной фазы | С уменьшением размеров частиц резко интенсифицируется процесс структурообразования. При переходе в область размеров коллоидной дисперсности ему начинает сопутствовать самопроизвольное диспергирование (включение частиц в броуновское движение). d кр – максимальный размер частиц, при котором возможно образование структуры. |
| Форма частиц дисперсной фазы | Чем сильнее анизометрия частиц, тем при меньшей их концентрации возникает структура (появляется предел текучести). В основе образования структур лежит коагуляционный механизм, сцепление частиц проходит по углам, ребрам и др. – участки максимальной концентрации свободных молекулярных сил (разрывы адсорбционно-сольватных оболочек среды). Форма частиц, близкая к сферической, противодействует структурообразованию. |
Совместное действие всех четырех факторов структурообразования оценивается по величине предельного напряжения сдвига Рт: 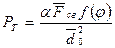 , где a - коэффициент, учитывающий геометрию упаковки частиц (a»1); F св = среднее значение сил сцепления в контакте; f (j) – функция концентрации; d 02 - средний характерный размер частиц.
, где a - коэффициент, учитывающий геометрию упаковки частиц (a»1); F св = среднее значение сил сцепления в контакте; f (j) – функция концентрации; d 02 - средний характерный размер частиц.
Видно, что РТ (как и вязкость системы), возрастает с уменьшением среднего характерного размера. 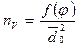 - характеризует число контактов между частицами в единице объема
- характеризует число контактов между частицами в единице объема
4. Свойства паст
Пасты – структурированные системы, поэтому определяющими являются их структурно-механические свойства, характеризующиеся вязкостью, упругостью, пластичностью.
Пасты имеют коагуляционную структуру, поэтому их механические свойства определяются свойствами межчастичных жидких прослоек, через которые действуют силы притяжения между частицами, зависящие от расстояния между ними и обусловленные Ван-дер-ваальсовыми и водородными связями. Т.е. механические свойства паст обусловлены двумя основными причинами:
1) молекулярным сцеплением частиц дисперсной фазы в местах контакта (где толщина прослоек среды минимальна). Коагуляционное взаимодействие частиц вызывает образование структур с выраженными обратимыми упругими свойствами;
2) наличием тончайшей пленки в местах контакта между частицами.
Коагуляционные структуры отличаются резко выраженной зависимостью структурно-механических свойств от интенсивности механических воздействий.
| Тиксотропия | Синерезис | Набухание |
| Уменьшение вязкости системы во времени при наложении нагрузки и постепенный рост вязкости при снятии нагрузки. Способствует эффективному проведению ряда технологических операций (напр., вибрационная обработка материалов с разрушением структуры – облегчает процессы пепремешивания, обеспечивает плотную упаковку и т.д.). | Обусловлен нарастанием числа и прочности межчастичных контактов во времени (иногда появлением кристаллизационных мостиков между частицами). Коагуляционная структура переходит в конденсационно-кристаллизационную с «выжиманием» жидкости. Но играет и отрицательную роль – при хранении структура уплотняется, ухудшается качество продукта. | · Если связи между частицами прочные, пасты набухают незначительно. · Если связи слабые, то структура пасты разрушается, система переходит в разбавленную суспензию (бесструктурную систему). · Если структура пасты прочная, поглощение среды приводит к пластификации (резкому понижению прочности) |
5. Устойчивость паст
| Седиментационная | Агрегативная |
| Система седиментационно устойчива за счет фиксации положения частиц фазы в сплошной пространственной структурной сетке в результате возникновения коагуляционных межчастичных контактов. | Характеризуется множеством промежуточных состояний между «устойчивостью» (максимальное упрочнение пространственной сетки, h0, РТ = Рmax) и «неустойчивостью» - предельным разрушением структуры (hmin, РТ = 0), связанных с ослаблением или усилением связей в структурной сетке. |
Пасты получают концентрированием разбавленных суспензий, потерявших агрегативную устойчивость, т.е. образование и упрочнение структуры паст – результат отсутствия агрегативной устойчивости в разбавленных суспензиях. Т.обр., в пастах классическая агрегативная устойчивость отсутствует, но термин используют для оценки способности паст сохранять неизменной во времени пространственную структуру.
В коагуляционных структурах оболочки жидкой среды при сближении частиц полностью не вытесняются, а принимают минимальную толщину, близкую к бимолекулярному слою. Структурирование в самих пленках среды препятствует дальнейшему уменьшению толщины прослоек, оно усиливается при использовании стабилизаторов.
Стабилизаторы:
1) анионные коллоидные ПАВ;
2) неионогенные коллоидные ПАВ;
3) поверхностно-активные полимеры.
При их использовании реализуются 2 фактора: адсорбционно-сольватный и структурно-механический: ПАВ, адсорбируясь на поверхности частицы, снижают свободную поверхностную энергию, а длинноцепочечные углеводородные радикалы, образуя структуру в адсорбционном слое, придают упругость и прочность защитной оболочке.
Смесь анионоактивного и неионогенного ПАВ обладает синергетическим эффектом стабилизирующего действия. Механизм обусловлен образованием смешанного адсорбционного слоя, в результате чего увеличивается вклад адсорбционной и структурной составляющих факторов устойчивости структурно-механического барьера.
Если стабилизатор – ионогенный, то реализуется и электростатический фактор устойчивости – образование ДЭС на поверхности частиц и воникновение электростатических сил отталкивания.
6. Разрушение паст
Три этапа разрушения структуры
| Разрушение сплошной структурной сетки, сопровождающееся распадом на крупные агрегаты | Разрушение агрегатов с уменьшением их размеров и увеличением числа, высвобождением из агрегатов частиц, образование новых агрегатов | Предельное разрушение структуры при полном отсутствии агрегатов из частиц |
Воздействия, применяемые при разрушении структуры
| 1. | Механическое перемешивание |
| 2. | Вибрация (более эффективная – поличастотная, 10 Гц < n < 103 Гц |
| 3. | Ультразвук |
| 4. | Нагревание |
| 5. | Электромагнитное поле |
| 6. | Изменение природы поверхности твердых частиц (путем добавления коллоидных ПАВ) |
| 7. | Сочетание вышеописанных воздействий (существенно изменяет энергию активации процесса структуроразрушения) |
Эмульсии – микрогетерогенные системы Ж/Ж.
· Классификация эмульсий
| По концентрации дисперсной фазы | По полярности фазы и среды | |||
| Разбавленные Сd £ 0,1% об | Концентрированные 0,1% £ Сd £ 74% об | Высококонцентрированные Сd ³ 74% об | I рода (прямые) – М/В | II рода (обратные) – В/М |

| 
| 
|
· Методы получения эмульсий
· Конденсационные.
· Конденсация из паров. Инжекция паров одной жидкости над поверхностью другой. Пар пересыщается и конденсируется в виде капель 1 мкм.
· Замена растворителя. Вещество будущей фазы растворяют в «хорошем» растворителе – истинный р-р. Затем в полученный р-р вводят другой р-ль («портящий» первый), растворенное в-во объединяется в капли эмульсии.
· Диспергационные – дробление системы – двух несмешивающихся слоев.
· Механические.
· Метод прерывистого встряхивания;
· Применение смесителей;
· Применение гомогенизаторов.
· Ультразвуком. 20¸50×103 Гц.
· Электрические
Эмульгирование самопроизвольное – происходит без затрат энергии извне, обнаружено в двухкомпонентной (без эмульгатора) системе при температуре, близкой к критической.
5. Характеристики эмульсий
6. Дисперсность эмульсий. Определяется размерами частиц дисперсной фазы.
7. Устойчивость во времени.
8. Скорость расслоения эмульсии;
9. Время жизни отдельных капель в контакте с другими.
10. Концентрация дисперсной фазы.
11. Разбавленные. Есть броуновское движение, диффузия, светорассеяние – седиментационно-устойчивы;
3.1.1. Концентрированные. Седиментационно-неустой- чивы, легко наступает коалесценция.
3.1.2. Высококонцентрированные.
3.1.2.1. Сходны со структурированными системами – гелями.
3.1.1.1. При cd» 100% аналогичны пенам.
4. Устойчивость эмульсий – агрегативная (способность сохранять во времени неизменными размеры капель дисперсной фазы, т.е. противостоять коалесценции).
Факторы агрегативной устойчивости
1. Электростатический. Образование ДЭС вокруг капель ® энергетический барьер, препятствующий сближению частиц до расстояний, где силы притяжения преобладают над силами отталкивания.
2. Адсорбционно-сольватный. Адсорбция эмульгаторов на поверхности капель Þ уменьшение поверхностного натяжения на границе «капля-среда». Если эмульгаторы – ПАВ и ВМС, то образуется адсорбционно-сольватная оболочка (структурированная).
3. Структурно-механический. На поверхности капель образуется слой молекул эмульгатора с повышенной вязкостью и упругостью, препятствующий слиянию капель. Этот фактор – главный, если эмульгатор – ВМС и неионогенные ПАВ
1. Неорганические электролиты – наименее эффективные. Пример – KSCN в системе М/В – эмульсия I рода. Возникновение ДЭС на водной стороне межфазной поверхности (избирательная адсорбция SCN-, создание этими ионами малого отрицательного потенциала и малой плотности заряда). Силы отталкивания между ДЭС капель малы. Этот тип стабилизации слаб для получения эмульсий нужной концентрации и достаточного времени жизни.
2. ПАВ – хорошие эмульгаторы. Коллоидные ПАВ – дифильные молекулы, соотношение между гидрофильными свойствами полярной группы и липофильными (гидрофобными) свойствами углеводородного радикала определяется числом ГЛБ (гидрофильно-липофильным балансом). Стабилизация эмульсий ионогенными коллоидными ПАВ связана с адсорбцией и определенной ориентацией молекул ПАВ на поверхности капель. В соответствии с правилом уравнивания полярностей Ребиндера, полярные группы ПАВ обращены к полярной фазе, неполярные радикалы – к неполярной фазе. Чтобы ПАВ защищало каплю от слияния с другой каплей, оно должно создавать защитную оболочку снаружи капли Þ оно должно лучше (не полностью!) растворяться в дисперсионной среде, чем в жидкости капли. Растворимость ПАВ характеризуется числом ГЛБ, чем оно больше, тем сильнее баланс сдвинут в сторону гидрофильных свойств, т.е лучше в-во растворяется в воде. ПАВ с числом ГЛБ от 8 до 13 лучше растворимы в воде, чем в масле, образуют эмульсии I рода, Пав с числом ГЛБ от 3 до 6 образуют эмульсии II рода. Ионогенные ПАВ образуют ДЭС. Для предотвращения прямого контакта и коалесценции капель не нужно образовывать сплошной защитный слой, достаточно, чтобы слой занимал 40-60% поверхности капли.
Углеводородные радикалы ПАВ в эмульсиях I рода уходят вглубь капель, для хорошей вертикальной ориентации необходимо, чтобы они состояли минимум из 8-10 атомов углерода. Вертикальная ориентация неионогенных ПАВ на поверхности раздела приводит к образованию слоя полярных групп, являющихся центром гидратации – создание защитного гидратного слоя.
Стабилизация обратных эмульсий с помощью ПАВ не ограничивается факторами, обусловливающими уменьшение поверхностного натяжения. ПАВ с длинными радикалами на поверхности капель воды могут образовывать пленки различной вязкости (реализация структурно-механического фактора устойчивости), а также обеспечивать энтропийное отталкивание благодаря участию радикалов в тепловом движении.
3. ВМС. Еще лучшие стабилизаторы. Их длинные цепные молекулы с равномерным распределением полярных групп располагаются горизонтально в плоскости раздела «капля-среда», легко переплетаются между собой с образованием двумерных структур. Адсорбция ВМС на поверхности медленна и практически необратима. Некоторые протеины, адсорбируясь, становятся нерастворимы в воде. Если такие слои сжимать, происходит их разрушение с образованием осадков, остающихся на межфазной поверхности в виде прочной эластичной оболочки. ВМС-эмульгатор образует эластичный гель – разбухает в непрерывной фазе, а попыткам сжатия этого геля препятствуют осмотические силы (давление набухания). Т.е. при использовании как эмульгатора ВМС реализуется в первую очередь структурно-механический фактор - на поверхности капли создается структурированная прочная пленка. В случае высококонцентрированных эмульсий (капли фазы имеют форму многогранников, а среда в виде тонких прослоек между ними) прослойки являются структурированными защитными оболочками, придающими системе твердообразные свойства.
4. Порошки. Стабилизаторы, характерные только для эмульсий.
Требования к частицам порошка:
· ачастиц << акапель;
· должны иметь определенный угол смачивания в системе «масло-вода-твердое»;
· форма: должны быть пластинчатыми, сферические непригодны.
Избирательное смачивание не должно быть полным (тогда стабилизатор целиком погружен в фазу и не защищает каплю). Например, частицы гипса в эмульсии М/В благодаря своей гидрофильности почти полностью входят в воду и частично в масло, из-за чего они окружают каплю масла сплошным слоем и препятствуют слипанию с другими каплями.
5. Определение типа эмульсий.
В процессе получения эмульсии (особенно диспергационными методами) неизбежно образуются капли одной и другой жидкости. Однако во времени капли одной жидкости остаются раздробленной фазой, а другой жидкости – сливаются в среду, соответственно становясь эмульсией I или II рода, что зависит от ряда факторов. По правилу Банкрофта, жидкость, лучше растворяющая эмульгатор (лучше смачивающая), является дисперсионной средой. Существуют экспериментальные методы определения типа эмульсии.
Метод разбавления. В пробирку с водой вводят каплю эмульсии, встряхивают. Если равномерно распределяется в объеме воды – эмульсия М/В. Если капля не диспергируется, то В/М.
Метод смачивания гидрофобной поверхности. Капля наносится на парафиновую пластину, если дисперсионная среда – масло, капля растечется, если вода – соберется в шарик.
Определение непрерывной фазы. Каплю помещают на предметное стекло рядом с несколькими кристаллами растворимого в воде красителя, приводят в соприкосновение. Если среда окрашивается, то эмульсия типа М/В. Опыт повторяют с жирорастворимым красителем.
Измерение электропроводности. В эмульсию помещают 2 электрода, соединенные с источником переменного тока и лампой. Если эмульсия М/В – лампа загорится.
Специфическое свойство - обращение фаз эмульсий. На него влияют:
3) Объемная концентрация компонента;
4) Природа эмульгатора;
5) Концентрация эмульгатора;
6) Температура;
7) Динамика процесса эмульгирования.
В процессе обращения фаз вначале образуются оба типа, но становится преобладающей одна более устойчивая система.
6. Разрушение эмульсий: седиментация и коалесценция.
· Пример — отделение сливок от молока. Полного разрушения нет, а образуются две эмульсии, одна из которых богаче дисперсной фазой. Тогда капля радиусом r и плотностью r будет всплывать в более тяжелой жидкости плотности r0 и вязкостью h со скоростью uсед,определяемой уравнением Стокса:
Если r > r0, то капля опускается на дно под действием силы тяжести.
2. Полное разрушение эмульсии, когда в чистом виде выделяются все компоненты. Идет в две стадии: флокуляция и собственно коалесценция. Первая стадия: образуются агрегаты, легко распадающиеся при слабом перемешивании. Вторая стадия: агрегаты сливаются в одну большую каплю. Процесс небратим, т.к. на разрушение больших капель на малые и восоздание эмульсии требуется сильное перемешивание.
Методы
1. Химические. Удаление барьеров, препятствующих коалесценции. Деэмульгаторы нейтрализуют действие защитного слоя — сероуглерод растворяет защитные пленки. Прямые эмульсии, стабилизированные эмульгаторами, разрушают добавлением электролитов с поливалентными ионами. Такие ионы не только сжимают ДЭС, но и переводят эмульгатор в малорастворимую в воде форму. Эмульгатор можно нейтрализовать другим эмульгатором, способствующим образованию эмульсии обратного типа — добавляется вещество более поверхностно-активное, чем эмульгатор, которое само не образует прочных пленок: спирты (пентиловый, амиловый...) вытесняют эмульгаторы, растворяют их пленки и способствуют коалесценции.
2. Термические. Эмульсии можно разделить на компоненты нагреванием до высокой температуры с последующим отстаиванием. Вероятно, нагревание ускоряет химические реакции в эмульсиях, изменяет природу поверхностного слоя, уменьшает вязкость — возникают условия, благоприятные для распада эмульсии. При замораживании зарождаются кристаллы льда, захватывающие воду при росте, капли масла сжимаются, кристаллизуются растворенные соли. При этом разрываются оболочки, препятствующие коалесценции.
3. Осаждение (силы тяжести, центробежные силы). Грубые эмульсии (нефтяные) содержат капли больших размеров. Для разделения жидкостей эмульсии выдерживают в отстойнике, но мелкие капли остаются во взвешенном состоянии. Более эффективно использование центрифуг — более тяжелая жидкость выталкивается к периферии и отводится, более легкая собирается вблизи центра.
4. Электрические. Методы применимы в двух случаях: когда капли заряжены; когда они электронейтральны, но приобретают дипольный момент, индуцируемый в постоянном или переменном электрическом поле — происходит коалесценция диполей.
ПЕНЫ
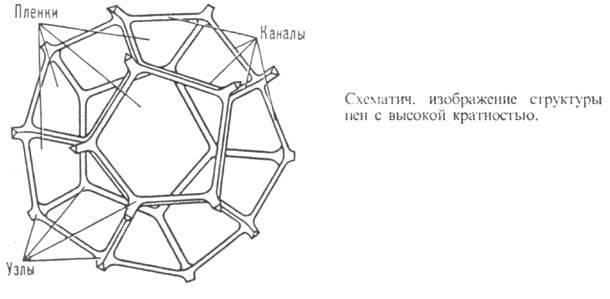
Пены – грубодисперсные высококонцентрированные бесструктурные системы Г/Ж. Пены – микрогетерогенные системы, т.к. пузырьки газа имеют макроразмеры, а дисперсионная среда (жидкие пленки между пузырьками газа) имеет микроразмеры.
Если пена монодисперсна, то каждый пузырек имеет форму правильного пентагонального додекаэдра — двенадцатигранника, любая сторона которого является правильным пятиугольником. Рис. 1 Многогранные пузырьки газа разделены тонкими прослойками дисперсионной среды, в зоне соприкосновения трех пленок — канал Плато. Рис. 2.
1-е правило Плато: т. к. натяжение пленок g=2s одинаково, силы натяжения их в одной плоскости уравновешиваются только при одинаковых углах (1200) между пленками.
2-е правило Плато: В каждой вершине многогранника (ячейки) сходятся четыре канала, образуя угол, равный 109028'.
Монодисперсная пена наиболее устойчива, характеризуется минимальной поверхностной энергией. У полидисперсной пены вследствие нарушения формы правильного пентагонального додекаэдра устойчивость снижена.
Классификация пен. Основана на кратности, показывающей, сколько объемов пены можно получить из одного объема жидкости: 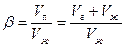
| Кратность b£10 | 10£b£100 | b³100 |
| Жидкие | Полусухие | Сухие |
Методы получения пен.
Установлено, что образование сколько-нибудь устойчивой пены в чистой жидкости невозможно, только в присутствии стабилизатора-пенообразователя. Если взять в этом качестве ПАВ, то молекулы ПАВ адсорбируются на поверхности пузырька газа, образуя монослой. Всплывая, каждый пузырек достигает поверхности жидкости, давит на нее, растягивает и образует полусферический купол. Молекулы пенообразователя из раствора устремляются к растущей поверхности, адсорбируются на ней, предотвращая разрыв пленки жидкости, т. обр., пузырек окружен оболочкой уже из двух монослоев пенообразователя, между которыми — пленка жидкости.
Адсорбционные слои ПАВ обеспечивают длительное существование возникающих пленок. Увеличение числа пузырьков на поверхности раствора ведет к их сближению, а форма пузырьков переходит из сферической в многогранную, толщина жидких перегородок уменьшается, возникают тонкие жидкие пленки.
Методы получения
7. Диспергационные — дробление газа на пузырьки при подаче в раствор.
1.1. Прохождение струй газа через жидкость (аэрационные и барботажные установки).
1.2. Действие движущихся устройств на жидкость (мешалки).
1.3. Эжектирование (пеногенераторы).
2. Конденсационные — будущая газовая фаза уже присутствует в виде отдельных молекул, из которых образуются пузырьки.
2.1. Изменение параметров физического состояния системы: а)Понижение давления пара над раствором;
б) повышение температуры раствора.
Растворимость газа увеличивается с повышением давления и понижением температуры. Если ¯Р и Т, растворенный в жидкости газ выделится и при наличии пенообразователя образуется пена.
2.2. Химическая реакция, сопровождающаяся выделением газа. Взаимодействие соды с кислотой – приготовление пресного теста, где в качестве разрыхлителя – питьевая сода NaHCO3 и лимонная кислота.
2.3. Использование микробиологических процессов с выделением CO2 (брожение).
2.4. Электрохимические процессы (электрофлотация). Электролиз воды – на катоде выделяется водород, на аноде – кислород. Газ + ПАВ в системе – образуется пена.
3. Характеристики пен.
3.1. Кратность пены;
3.2. Дисперсность пены. Оценивают:
3.2.1. Средний радиус пузырька;
3.2.2. Максимальное расстояние между противолежащими стенками пузырька (условный диаметр);
3.2.3. Удельная поверхность раздела «жидкость-газ»;
3.2.4. Устойчивость во времени - время с момента образования пены до самопроизвольного разрушения.
Методы определения дисперсности:
8. Микрофотографирование пены - прямое определение размера пузырьков;
9. По электропроводности: измерение электросопротивления столба пены между двумя пористыми пластинами;
10. Измерение удельной поверхности – площади поверхности пузырьков в 1см3 или в 1 г пеномассы.
4. Свойства пен
4.1. Структурно-механические (реологические).
4.1.1.Предельное напряжение сдвига. Выражается через жесткость - способность пены воспринимать механические нагрузки;
4.1.2.Вязкость. Позволяет определять условия перекачивания пены по поверхности (трубы и т.д.);
4.2. Электрические. Электропроводна только жидкая фаза Þ уд. элек-ть k F зависит от содержания жидкой фазы и ее k L 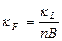 , где n – кратность пены, B – коэффициент формы, зависит от кратности пены и возрастает от 1,5 до 3,0
, где n – кратность пены, B – коэффициент формы, зависит от кратности пены и возрастает от 1,5 до 3,0
4.3. Оптические. Интенсивность светового потока уменьшается лишь в результате рассеяния (доля жидкости мала). Три вида поверхности раздела фаз – пленки, каналы Плато, узлы. Ослабление светового потока определяется соотношением 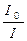 , где I 0 – инт-ть падающего света; I – инт-ть света, прошедшего через систему
, где I 0 – инт-ть падающего света; I – инт-ть света, прошедшего через систему
5. Устойчивость пен
Системы термодинамически неустойчивы (относительно устойчивы).
Агрегативная
Реальная пена полидисперсна. Чем меньше пузырек газа, тем больше давление в нем, → самопроизвольно идет процесс диффузии газа из маленьких пузырьков в большие, маленькие пузырьки становятся меньше, большие – больше, т.е. меняется стабильность пены. Больше различие в размерах пузырьков – сильнее диффузия газа. Кроме степени полидисперсности на скорость диффузионного разрушения пены влияют:
Растворимость газа в жидкой пленке;
Коэффициент диффузии газа в жидкой пленке;
Толщина жидких пленок;
Поверхностное натяжение раствора пенообразователя.
Седиментационная.
Нарушение седиментационной устойчивости пен связано с процессом самопроизвольного стекания ж-ти в пленке пены, ее утончению и разрыву – действие сил гравитации и капиллярных сил всасывания. Ж-ть стекает по каналам Плато. Стенка м/у соприкасающимися пузырьками одинакового размера плоская – плоский капилляр, т.е. ж-ть стенки под тем же давлением, что и газ в двух пузырьках. Но поверхность «ж-ть – воздух» вблизи места соединения трех пузырьков (граница Плато) вогнута по отношению к газ. Фазе, т.е. жидкость на границе Плато под отрицательным капиллярным давлением, и перепад давления гонит жидкость из плоской стенки м/у пузырьками к границе Плато. Утончение пленок возможно и при испарении.
Разрыв пленки по Дерягину, включает три стадии:
а) Постепенное утончение всей пленки;
б) скачкообразное появление отдельных участков меньшей толщины, чем толщина пленки;
в) образование на этих участках отверстий, расширяющихся с большой скоростью.
Факторы, влияющие на устойчивость пены.
i. Факторы, связанные с наличием пенообразователя. Используют коллоидные ПАВ или ВМС.
Для ПАВ: используют средние члены гомологических рядов, анионные ПАВ лучше катионных и неионогенных. Для ВМС: лучшие пенообразователи – полиэлектролиты (белки).
ii. Факторы, связанные со свойствами дисперсионной среды.
Среда характеризуется:
Вязкостью – больше вязкость, устойчивее пена;
рН – в основном в щелочной области (для жирных кислот и их солей). Максимальная пенообразующая способность белковых растворов в изоэлектрической точке;
Наличием в жидкости низкомолекулярных электролитов – в жесткой воде (большое количество солей) кратность и устойчивость пен невысока.
11. Факторы, связанные с внешними воздействиями:
Температура;
Испарение жидкости из пленки;
Понижение вязкости жидкости в пленке.
Температура отрицательно влияет на устойчивость пены, т.к. усиливает десорбцию молекул пенообразователя, ускоряет испарение ж-ти из пленки, понижает вязкость ж-ти пленки. Однако для теста, белковых пен термообработка приводит к образованию твердообразных систем (твердая пена) – абсолютно устойчивых.
Механические воздействия влияют отрицательно на устойчивость пены, т.к. происходит механическое разрушение структуры пены, усиливается испарение ж-ти из пленки.
12. Разрушение пен
6.1. Предупреждение пенообразования.
6.1.1. Эффект ограниченного пенообразования при совместном применении двух ПАВ.
6.1.2. Удаление стабилизаторов пен из растворов, содержащих ПАВ.
6.1.3. Изменение режима технологического процесса, параметров технических аппаратов.
6.2. Собственно способы разрушения пен.
6.2.1. Химические.
6.2.1.1. Антивспениватели. Взаимодействие с пенообразователем с образованием малорастворимых соединений.
6.2.1.2. Химически не взаимодействующие с пенообразователем, разрушение пены в результате физических процессов.
6.2.2. Нехимические.
6.2.2.1. Физические.
6.2.2.1.1. Термические.
6.2.2.1.2. Акустические.
6.2.2.1.3. Электрические.
6.2.2.2. Механические
АЭРОЗОЛИ
V. Аэрозоли – микрогетерогенные системы Т/Г или Ж/Г.
К системам с газовой дисперсионной средой относятся аэрозоли и сыпучие материалы (порошки). Аэрозоли - это дисперсные системы, в которых частицы дисперсной фазы находятся во взвешенном состоянии.
Сыпучие материалы можно рассматривать как осадок аэрозолей с твердой дисперсной фазой, т.е. как систему Т/Г.
Для аэрозолей сложилась своя классификация в зависимости от агрегатного состояния и размеров частиц дисперсной фазы. Эта классификация приведена в табл.8.1. Простейшими являются аэрозоли, дисперсная фаза которых состоит только из твердых частиц или из капель. Каждая из разновидностей аэрозольных систем имеет свое название. Высоко- и среднедисперсные сист
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 3604; Нарушение авторских прав?; Мы поможем в написании вашей работы!