
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие положения. Лекция №1 Модели строения атомов и их свойства
|
|
|
|
Лекция №1 Модели строения атомов и их свойства
СОВРЕМЕННАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН И СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Краткий курс лекций
СРЕДСТВА ОБЕСПЕЧЕНИЯ ОСВОЕНИЯ МЕЖДИСЦИПЛИНАРНОГО КУРСА
Для обеспечения дисциплины необходимо наличие:
- аудиторного фонда и литературы;
- оборудования и материалов.
МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
Для обеспечения данной дисциплины необходимы: оборудованные аудитории; различные технические средства обучения; аудио-видеоаппаратура; наглядные пособия.
Цель: Сформировать у студентов понятие об атомной модели. Познакомить их с исторически имеющимися моделями.
Согласно современным представлениям, атом – это наименьшая частица химического элемента, являющаяся носителем его химических свойств. Атом электрически нейтрален и состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые движутся определённым образом вокруг ядра. Ядро атома, не изменяющееся в ходе химических реакций, составляет его фундаментальную основу и определяет индивидуальность элемента. Поэтому значение заряда ядра выбрали за основной признак, по которому атомы относят к разным видам – химическим элементам.
Ядра атомов включают два вида элементарных частиц: протоны и нейтроны.
Основные характеристики электрона, протона и нейтрона приведены в табл. 1.1.
Таблица 1.1 Сведения о некоторых элементарных частицах.
| Частица | Символ | Масса | Заряд | ||||||||||
| кг | а.е.м. | Кл. | Усл.ед. | ||||||||||
| протон | p | 1, 673 10-27 | 1, 007276 | 1, 602 10-19 | +1 | ||||||||
| нейтрон | n | 1, 675 10-27 | 1, 008665 | ||||||||||
| электрон | e | 9, 109 10-31 | 0, 000547 | 1, 602 10-19 | -1 | ||||||||
Каждый протон несёт положительный заряд, численно равный заряду электрона. Нейтрон же не несёт никакого электрического заряда. Отсюда следует вывод: заряд ядра определяется числом протонов. Количество протонов в ядре атома совпадает с порядковым номером элемента (Z) в периодической системе элементов Д.И. Менделеева.
Как видно из данных табл. 1.1, масса электрона почти в 1840 раз меньше массы протона и нейтрона. В ядре сосредоточено 99,9% массы атома, поэтому масса атома практически равна массе ядра – сумме масс протонов и нейтронов.
Общее число протонов (Z) и нейтронов (N) в ядре называется массовым числом A:
A=Z+N.
Поскольку массы протона и нейтрона практически равны 1а.е.м., то масса атома в а.е.м., как и относительная атомная масса, численно совпадает со значением массового числа А.
Силы, удерживающие протоны и нейтроны в ядре, называют ядерными. Это чрезвычайно большие силы, действующие на очень коротких расстояниях (порядка 10-13 см) и превосходящие силы отталкивания. Природу этих сил изучает ядерная физика.
Исследования показали, что в природе атомы одного и того же элемента имеют различные атомные массы. Так, атомы хлора имеют массу 35 и 37. Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов. Атомы с одинаковым числом протонов, но с различным числом нейтронов называются изотопами. Для обозначения изотопов пользуются обычными символами соответствующих элементов, добавив к ним слева вверху индекс, указывающий массовое число изотопа, внизу – индекс, указывающий количество протонов, равное порядковому номеру (Z) элемента (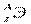 ).
).
В периодической таблице элементов Д.И. Менделеева приводятся усреднённые значения относительных атомных масс с учётом распространённости различных изотопов в природе.
Атомы с различным числом протонов Z и нейтронов N, но с одинаковым числом нуклонов (Z+N) называются изобарами, а с одинаковым числом нейтронов (N) – изотонами.
Примеры изобаров и изотонов:
Изобары Изотоны
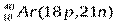
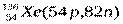
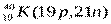
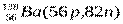
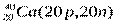

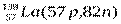
Поскольку атом в целом является электронейтральным, а заряд электрона численно равен заряду протона и противоположен ему по знаку, то общее число электронов в атоме равно числу протонов и, следовательно, равно порядковому номеру элемента в периодической системе элементов.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 281; Нарушение авторских прав?; Мы поможем в написании вашей работы!