
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовые числа
|
|
|
|
Для характеристики поведения электрона в атоме введены квантовые числа: главное, орбитальное, магнитное и спиновое.
Главное квантовое число n определяет энергию электрона на энергетическом уровне и размер атомной орбитали. Оно может принимать целочисленные значения от 1 до  (практически от 1 до 7 соответственно номеру периода, в котором находится элемент). Чем больше n, тем больше энергия электрона и размер атомной орбитали (электронного облака).
(практически от 1 до 7 соответственно номеру периода, в котором находится элемент). Чем больше n, тем больше энергия электрона и размер атомной орбитали (электронного облака).
Энергия электрона, главным образом, зависит от расстояния электрона от ядра: чем ближе к ядру находится электрон, тем меньше его энергия и размер электронного облака.
Состояние электрона, характеризующееся определённым значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме. Энергетические уровни обозначают прописными буквами согласно схеме:
Значение n: 1 2 3 4 5 6 7. Обозначение: K,L,M,N,O,P,Q.
Так, если n=3, то электрон находится на третьем уровне от ядра или на М уровне и, наоборот, для пятого уровня (О – уровня) n=5.
Конечно, никаких уровней в атоме нет; говоря так, понимают лишь энергетическое состояние электрона, что и определяет его положение в атоме. Электроны, характеризующиеся одним и тем же значением главного квантового числа, образуют в атоме электронные облака приблизительно одинаковых размеров, поэтому можно говорить о существовании в атоме электронных слоев, или электронных оболочек, отвечающих определенным значениям главного квантового числа. При переходе электрона с уровня на
 уровень выделяются или поглощаются кванты энергии, которые могут проявиться в виде линий спектров (рис. 1.2).
уровень выделяются или поглощаются кванты энергии, которые могут проявиться в виде линий спектров (рис. 1.2).
Было установлено, что энергетические уровни расщепляются на энергетические подуровни.
Согласно квантово – механическим расчётам, электронные облака отличаются не только размерами, но и формой.
Орбитальное квантовое число l характеризует форму атомной орбитали (электронного облака) и энергию электрона на энергетическом подуровне.
Состояния электрона, характеризующиеся различными значениями орбитального квантового числа l принято называть энергетическими подуровнями электрона в атоме (подоболочками). Как и n, l квантуется, т.е изменяется только целочисленно, принимая значения от 0 до (n-1), где n – главное квантовое число, всего n значений.
Энергетические подуровни обозначают буквами:
значение l: 0 1 2 3 4 5; обозначение подуровня: s p d f g h.
В соответствии с этими обозначениями говорят об s - подуровне, p – подуровне и т.д. Число подуровней равно номеру уровня. То есть орбитальное квантовое число l описывает структуру энергетического уровня.
Электроны с орбитальным квантовым числом 0 называются s – электронами. Орбитали (электронные облака) имеют сферическую форму (рис. 2.3, а).
Электроны с орбитальным квантовым числом 1 называются p – электронами. Орбитали имеют «гантелевидную» форму (рис. 2.3,б).
Электроны с l =2 называют d – электронами. Орбитали имеют форму сложной  «четырехлепестковой» фигуры (рис. 2.4, в).
«четырехлепестковой» фигуры (рис. 2.4, в).
Электроны с l =3 получили название f – электронов. Форма их орбиталей ещё сложнее, чем форма d – орбиталей.
В одном и том же энергетическом уровне энергия подуровней возрастает в ряду ES<eP<ed<ef.
Магнитное квантовое число ml характеризует пространственную ориентацию атомной орбитали и связано с числом l, квантуется и принимает целочисленные значения, от -l до +l, включая ноль. Число значений m l равно 2 l +1. Это число орбиталей с данным значением l, т.е. число энергетических состояний, в которых могут находиться электроны данного подуровня.
Внешнее магнитное поле изменяет пространственную ориентацию электронных облаков, поэтому при воздействии магнитного поля происходит расщепление энергетических подуровней электронов. В магнитном поле наблюдается расщепление атомных спектральных линий.
Общее число состояний (орбиталей) на уровне равно n2. На рис. 2.3 показаны формы и ориентация в пространстве 1s –, 2p –, 3d – орбиталей.
На основе представлений о квантовых числах можно уточнить определение атомной орбитали (АО): совокупность положений электрона в атоме, характеризуемых определёнными значениями квантовых чисел n,l и ml: называют атомной орбиталью (АО). Условно АО обозначают в виде клеточки (энергетической или квантовой ячейки) – □. Соответственно, для s – подуровня одна АО – □, для p – подуровня три АО – □□□, для d – подуровня пять АО – □□□□□, для f – подуровня семь АО – □□□□□□□.
Изучение тонкой структуры атомных спектров показало, что, кроме различия размеров облаков, их формы и характера расположения в пространстве относительно друг друга, электроны различаются спином. Упрощенно спин можно представить как собственное вращение электрона вокруг своей оси (от англ. spin – веретено).
Спиновое квантовое число ms характеризует собственный момент количества движения электрона, обусловленный его движением вокруг своей оси; ms =±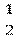 .
.
Знаки “+” и “–“ соответствуют различным направлениям вращения электрона – по или против часовой стрелки. Электроны с разными спинами называются антипараллельными или спаренными и обозначаются противоположно направленными стрелками ↑↓. Неспаренный электрон изображается одной стрелкой.
Итак, состояние электрона в атоме полностью характеризуется четырьмя квантовыми числами: n, l, ml и ms. </e</e</e
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 639; Нарушение авторских прав?; Мы поможем в написании вашей работы!