
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направленность ковалентной связи
|
|
|
|
Согласно МВС наиболее прочные химические связи возникают в направлении максимального перекрывания атомных орбиталей. Поскольку атомные орбитали имеют определённую форму, их максимальное перекрывание возможно при определённой пространственной ориентации, поэтому ковалентная связь характеризуется направленностью. Иначе говоря, направленность заключается в том, что максимальное перекрывание валентных электронных облаков взаимодействующих атомов возможно при определенной их взаимной ориентации. Направленность ковалентной связи определяет пространственную конфигурацию молекул.
В зависимости от направления перекрывания атомных орбиталей различают σ -, π – и δ – связи.
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ – связью. Сигма-связь может возникать при перекрывании s – орбиталей (рис. 3.3,а), s –, p – орбиталей (рис. 3.3,б), р – орбиталей (рис. 3.3,в), d – орбиталей (рис. 3.3,г), а также d – и s – орбиталей, и f – орбиталей с друг другом и другими орбиталями. Сигма – связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью.
Простейший случай σ – связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (s-s перекрывание, рис. 3.4). Геометрическая форма молекулы линейная.
Рассмотрим образование молекулы HCl. 
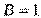
3s 3p 3d
Исходя из стехиометрического состава молекулы HCl и валентности водорода, равной единице, мы видим, что хлор, находясь в невозбужденном состоянии, проявляет валентность В=1 (в возбужденном состоянии хлор проявляет валентности 3, 5, 7). При образовании молекулы HCl происходит перекрывание s – орбитали атома водорода с р – орбиталью атома хлора (s – р перекрывание). Молекула имеет линейную форму (рис. 3.5). Очевидно, такие же линейные молекулы должны образовать с водородом аналоги 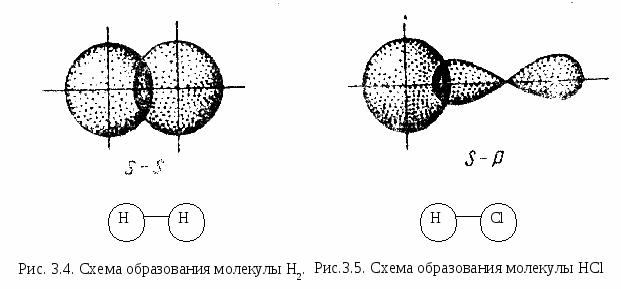 хлора – бром, йод, астат.
хлора – бром, йод, астат.
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью. Пи-связь может образовываться при перекрывании р – р-орбиталей (рис. 3.6, a), p – d-орбиталей (рис. 3.6,б), d – d-орбиталей (рис. 3.6,в), а также f – p-, f – d- и f – f-орбиталей.
Связь, образованная перекрыванием d-орбиталей всеми четырьмя «лепестками» называется δ-связью (дельта-связью, рис. 3.7).
Соответственно, s-элементы могут образовывать только σ-связи, р-элементы – σ- и π-связи, d-элементы – σ-, π- и δ-связи, а f-элементы – σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей.
Р
Рис. 3.6. Перекрывание атомных орбиталей при образовании π-связей

Рис. 3.7. Направления перекрывания атомных d – орбиталей при образовании δ-связей
Кратность связи. Связь, которая образована одной электронной парой между двумя атомами, называется одинарной. Одинарная связь всегда σ – связь. Химическая связь может осуществляться более чем одной парой электронов. Связь, образованная более чем одной электронной парой, называется кратной (двойной или тройной), которая образуется при наложении σ -, π – и δ – связей. В кратных связях одна из связей обязательно является σ – связью.
При наложении π-связи на σ-связь образуется двойная связь, например в молекулах кислорода, этилена, диоксида углерода. Кратная связь изображается двумя черточками: О =О, С = С, О = С = О.
Хотя энергия π-связи меньше, чем энергия σ-связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи. При наложении двух π-связей на σ-связь возникает тройная связь, например в молекулах азота, ацетилена и оксида углерода. Тройная связь изображается тремя черточками: N ≡ N, ─ C ≡ C ─, C ≡ O. Энергия тройной связи выше, а длина связи ниже, чем энергии и длины простой и двойной связей.
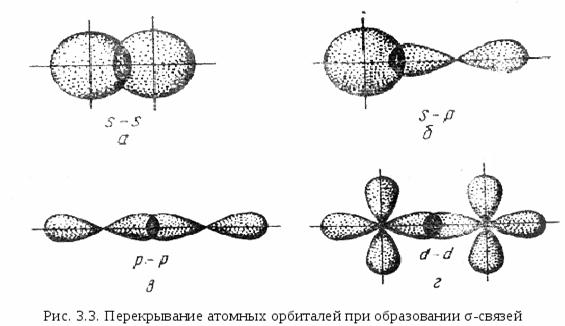
Число связей между атомами в МВС называется кратностью связи. Примером образования кратной связи может служить молекула азота N2.
На рис. 3.8,а показано расположение в пространстве р - орбиталей в двух атомах азота. В молекуле азота рх – орбитали образуют одну σ-связь (рис. 3.8,б). При образовании связи рz – орбиталями (рис. 3.8,в) возникают две области перекрывания – выше и ниже оси Х, т. е. образуется π – связь. Вторую π – связь в молекуле азота образуют ру – орбитали атомов (рис. 3.8,г). Молекула N2 линейна. Таким образом, пространственное расположение σ – связей определяет пространственную конфигурацию молекул. В некоторых молекулах и ионах, содержащих двойные связи, π-связи являются делокализованными, т. е. охватывающими не два атома, а часть или целые молекулы или ионы. Например, структура молекулы 1, 3-бутадиена может быть записана в двух формах.
некоторых молекулах и ионах, содержащих двойные связи, π-связи являются делокализованными, т. е. охватывающими не два атома, а часть или целые молекулы или ионы. Например, структура молекулы 1, 3-бутадиена может быть записана в двух формах.
В действительности в чистом виде не существует ни та, ни другая структура, а гибридная структура, в которой π – электроны не принадлежат двум конкретным атомам, а всей молекуле в целом. Пи-связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами, называются делокализованными связями, обозначаемыми пунктиром:

Приведенная структура называется резонансной.
Д ругими примерами соединений с делокализованными связями служат молекула озона О3, бензола С6Н6, а также ионы NO3‾, СО32-, SO42-:
ругими примерами соединений с делокализованными связями служат молекула озона О3, бензола С6Н6, а также ионы NO3‾, СО32-, SO42-:


Пространственные формы молекул весьма разнообразны. Так, молекула СО2 имеет линейную структуру, молекула СН4 – тетраэдрическую, молекула NH3 – пирамидальную, воды – угловую, SO3 – треугольную.
Для объяснения пространственной конфигурации молекул используется модель (теория) гибридизации атомных орбиталей.
Гибридизация атомных орбиталей. В молекуле метана СН4 существуют четыре связи С – Н, имеющие одинаковые длины и энергии. Между тем у углерода в возбужденном состоянии имеются три р- и одна s-орбитали с неспаренными электронами, которые перекрываются s-орбиталями водорода. Исходя из этого, можно было бы ожидать, что характеристики одной из связей в молекуле метана будут отличаться от характеристик других связей. В действительности, все четыре связи в молекуле метана равноценны.
Для объяснения данного факта американский ученый Л. Полинг разработал теорию о гибридизации атомных орбиталей. Основные положения теории гибридизации АО:
1. Если у атома, вступающего в химическую связь, имеются разные АО (s-, р-, d- или f-АО), то в процессе образования химической связи происходит гибридизация (смешение) АО, т.е. из разных АО образуются одинаковые (эквивалентные) АО. Следует подчеркнуть, что гибридные АО образуются у одного атома, имеющего разные орбитали. Причем гибридизация происходит у орбиталей, имеющих близкие значения энергии.
Иначе говоря, гибридизация – выравнивание по форме и энергии АО (облаков) с образованием новых АО, одинаковых по форме и энергии. Новые облака называются гибридными, их число равно сумме АО, участвующих в гибридизации.
Следует отметить, что как физический процесс, гибридизация орбиталей не существует. Теория гибридизации АО – это удобный и наглядный прием описания сложных процессов, происходящих при образовании химических  соединений.
соединений.
Рис. 3.9. Атомная sp – гибридная орбиталь
Форма гибридной АО отличается от формы исходных АО (рис. 3.9). В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит макс имальное перекрывание, которое приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула более устойчива.
Пространственная конфигурация молекул. Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют пространственную конфигурацию (геометрическую форму) молекул:
1. Если в химическую связь вступает атом, у которого на внешней оболочке имеется s- и р – электроны, то у данного атома в процессе образования связи происходит sp – гибридизация АО (рис. 3.10).
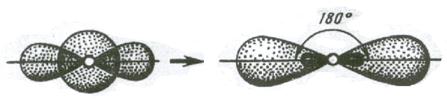
Рис. 3.10. Схема sp – гибридизации
Две sp – гибридные орбитали расположены симметрично под углом 180˚, отсюда и связи, образуемые с участием электронов этих орбиталей, также располагаются под углом 180˚. Например, у атома бериллия sp – гибридизация орбиталей проявляется в молекуле BeCl2, которая вследствие этого имеет линейную форму (рис. 3.13,а)

s-p – гибридизация характерна для атомов элементов II группы периодической системы (Be, Mg, Cd, Hg и т. д.), для углерода в СО2, в органических соединениях с тройной углерод – углеродной связью.
2. Если у атома, вступающего в химическую связь, на внешней оболочке имеется один s- и два p- электрона, то происходит sp2 – гибридизация АО орбиталей этого атома (рис. 3.11).
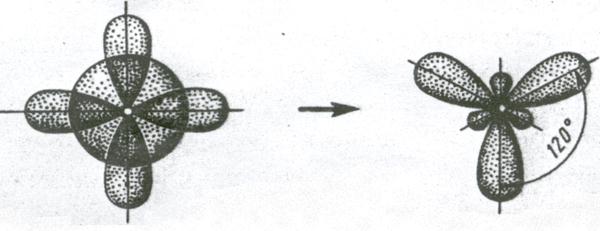
Рис. 3.11. Схема sp2 – гибридизации
Три sp2 – гибридные орбитали расположены под углом 120˚. Под таким же углом располагаются и связи, образованные с участием электронов этих орбиталей. Например, вследствие sp2 – гибридизации орбиталей атома бора молекула BCl3 имеет треугольную форму (рис. 3.13, б). Распределение химических связей можно представить следующей схемой:

sp2 – гибридизация встречается в молекулах элементов III группы периодической системы, а также в органических соединениях с двойной углерод – углеродной связью.
3. У атома, имеющего на внешней оболочке один s- и три р- электрона, при химическом взаимодействии происходит sp3 – гибридизация этих АО (рис. 3.12).
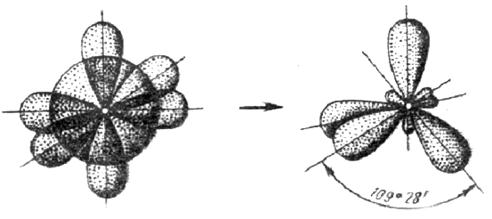
Рис. 3.12. Схема sp3 – гибридизации
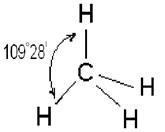
Четыре sp3 – гибридные орбитали симметрично ориентированы в пространстве под углом 109˚28′ к четырем вершинам тетраэдра (рис. 3.13, в). Тетраэдрическое расположение связей и форма тетраэдра характерны для элементов IV группы, в том числе для многих соединений углерода, например, CH4:
4. Возможны также более сложные виды гибридизации с участием d- и f- орбиталей атомов, при которых образуются молекулы ещё более сложной конфигурации.
Комбинация орбиталей типа одной s-, трех р- и одной d- приводит к sp3d-гибридизации. Это соответствует пространственной ориентации пяти sp3d-гибридных орбиталей к вершинам тригональной бипирамиды (рис. 3.13, г). В случае sp3d2-гибридизации шесть sp3d2-гибридных орбиталей ориентируются к вершинам октаэдра (рис. 3.13, д). Ориентация семи орбиталей к вершинам пентагональной бипирамиды (рис. 3.13, е) соответствует sp3d3 (или sp3d2f) – гибридизации валентных орбиталей центрального атома молекулы (комплекса).
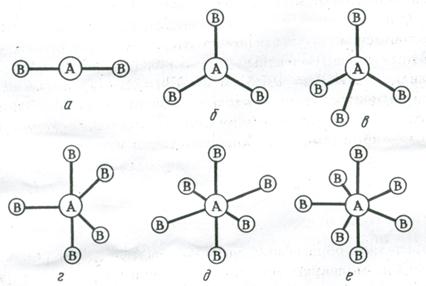
Рис. 3.13. Пространственное расположение связей и конфигурация молекул:
а – линейная; б – треугольная; в – тетраэдрическая; г – тригонально-бипирамидальная; д – октаэдрическая; е – пентагонально-бипирамидальная
Влияние несвязывающей электронной пары центрального атома на строение молекул. Рассмотренная выше теория гибридизации орбиталей центрального атома (обозначен в общих формулах через А) применима к большому количеству молекул и ионов. Однако для ряда молекул и ионов, особенно имеющих несимметричное строение, рассмотренных представлений оказывается недостаточно. В подобных случаях применяют теорию полной гибридизации (Джиллеспи), в которой и связывающие, и неподеленные электронные пары центрального атома подвергаются sp3 – гибридизации. sp3 – гибридизация центральных атомов имеет место в молекулах NH3, H2O и им подобным, образованным их электронными аналогами.
У атома азота на четыре sp3 – гибридные орбитали приходятся пять электронов.
7 N
N  sp3-гибридизация
sp3-гибридизация
2s 2p
Следовательно, одна пара электронов оказывается несвязывающей и занимает одну из sp3-гибридных орбиталей, направленных к вершине тетраэдра (рис. 3.14). Молекула NH3 имеет форму тригональной пирамиды.

Рис. 3.14. Перекрывание валентных орбиталей в молекулах CH4, NH3, H2O
У атома кислорода на четыре sp3-гибридные орбитали приходится шесть электронов:
8О 
2s 2p
Теперь уже несвязывающие электронные пары занимают две гибридные sp3-орбитали. Молекула H2O имеет угловую форму (рис. 3.14).
В представлениях теории гибридизации уменьшение валентного угла НЭН в ряду СН4 (109,5˚) – NH3 (107,3˚) – H2O (104,5˚) объясняется следующим образом. В ряду С-N-О энергетическое различие между 2s- и 2р – орбиталями увеличивается, поэтому вклад 2s-орбиталей при гибридизации с 2р-орбиталями уменьшается. Это приводит к уменьшению валентного угла и постепенному приближению его к 90˚.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2703; Нарушение авторских прав?; Мы поможем в написании вашей работы!