
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полярность молекул (типы ковалентных молекул)
|
|
|
|
Следует отличать полярность молекулы от полярности связи. Для двухатомных молекул типа АВ эти понятия совпадают, как это уже показано на примере молекулы HCl. В таких молекулах чем больше разность электроотрицательностей элементов (∆ЭО), тем больше электрический момент диполя. Например, в ряду HF, HCl, HBr, HI он уменьшается в той же последовательности, как и относительная электроотрицательность.
Молекулы могут быть полярными и неполярными в зависимости от характера распределения электронной плотности молекулы. Полярность молекул характеризуется значением электрического момента диполя μм, который равен векторной сумме электрических моментов диполей всех связей и несвязывающих электронных пар в молекулах. Результат сложения зависит от полярности связей, геометрического строения молекулы, наличия неподеленных электронных пар. Большое влияние на полярность молекулы оказывает её симметрия.
Поэтому, хотя связи С=О и имеют сильно полярный характер, вследствие взаимной компенсации их электрических моментов диполя молекула СО2 в целом неполярна (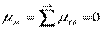 ). По этой же причине неполярны высокосимметричные тетраэдрические молекулы СН4, СF4, октаэдрическая молекула SF6 и т. д.
). По этой же причине неполярны высокосимметричные тетраэдрические молекулы СН4, СF4, октаэдрическая молекула SF6 и т. д.
Напротив, в угловой молекуле Н2О полярные связи О–Н располагаются под углом 104,5º. Поэтому их моменты взаимно не компенсируются и молекула оказывается полярной (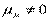 ).
).
Электрическим моментом диполя обладают также угловая молекула SO2, пирамидальные молекулы NH3, NF3 и т. д. Отсутствие такого момента свидетельствует о высокосимметричной структуре молекулы, наличие электрического момента диполя – о несимметричности структуры молекулы (табл. 3.2).
Таблица 3.2
Строение и ожидаемая полярность молекул
| Тип | Пространственная конфигурация | Ожидаемая полярность | Примеры |
| Линейная | Неполярная | 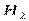 , , 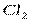 , , 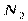
|
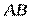
| Линейная | Полярная | 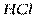 , , 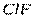
|
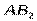
| Линейная | Неполярная | 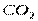 , , 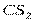 , , 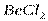
|
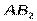
| Угловая | Полярная | 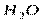 , , 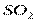 , , 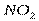
|
| Линейная | Полярная | 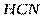
|
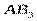
| Плоскотреугольная | Неполярная | 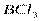 , , 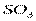
|
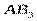
| Тригонально-пирамидальная | Полярная | 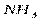 , , 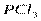 , , 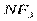
|

| Тетраэдрическая | Неполярная | 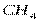 , , 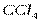 , , 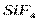
|
На значение электрического момента диполя молекулы сильно влияют несвязывающие электронные пары. Например, молекулы NH3 и NF3 имеют одинаковую тригонально-пирамидальную форму, полярность связей N–H и N–F также примерно одинакова. Однако электрический момент диполя NH3 равен 0,49·10-29 Кл·м, а NF3 всего 0,07·10-29 Кл·м. Это объясняется тем, что в NH3 направление электрического момента диполя связывающей N–H и несвязывающей электронной пары совпадает и при векторном сложении обусловливает большой электрический момент диполя. Наоборот, в NF3 моменты связей N–F и электронной пары направлены в противоположные стороны, поэтому при сложении они частично компенсируются (рис. 3.15).
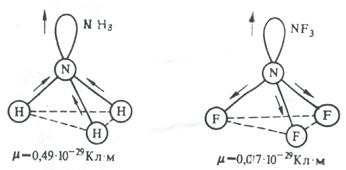
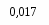
Рис 3.15. Сложение электрических моментов диполя связывающих и несвязывающих электронных пар молекул NH3 и NF3
Неполярную молекулу можно сделать полярной. Для этого её надо поместить в электрическое поле с определенной разностью потенциалов. Под действием электрического поля «центры тяжести» положительных и отрицательных зарядов смещаются и возникает индуцированный или наведенный электрический момент диполя. При снятии поля молекула опять станет неполярной.
Под действием внешнего электрического поля полярная молекула поляризуется, т. е. в ней происходит перераспределение зарядов, и молекула приобретает новое значение электрического момента диполя, становится ещё более полярной. Это может происходить и под влиянием поля, создаваемого приблизившейся полярной молекулой. Способность молекул поляризоваться под действием внешнего электрического поля называют поляризуемостью.
Полярностью и поляризуемостью молекул обусловлено межмолекулярное взаимодействие. С электрическим моментом диполя молекулы связана реакционная способность вещества, его растворимость. Полярные молекулы жидкостей благоприятствуют электролитической диссоциации растворенных в них электролитов.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1877; Нарушение авторских прав?; Мы поможем в написании вашей работы!