
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические основы каталитических процессов
|
|
|
|
Общие сведения о катализе и катализаторах.
Катализ (этот термин впервые был предложен шведским химиком Берцелиусом в 1855 г.) является исключительно эффективным методом осуществления в промышленности химических превращений. В настоящее время до 90 % всей химической продукции мира изготавливается каталитическим путем. От развития катализа в значительной степени зависит технический прогресс химической, нефтехимической, нефтеперерабатывающей и других отраслей промышленности.
Катализ - многостадийный физико-химический процесс избирательного изменения механизма и скорости термодинамически возможных химических реакций веществом-катализатором, образующим с участниками реакций промежуточные химические соединения.
Различают положительный катализ - увеличение скорости реакции под влиянием катализатора, и отрицательный катализ, приводящий к уменьшению скорости химического превращения.
Следует отметить, что под термином «катализ» подразумевают преимущественно только положительный катализ.
Важной особенностью катализа является сохранение катализатором своего состава в результате промежуточных химических взаимодействий с реагирующими веществами. Катализатор не расходуется в процессе катализа и не значится в стехиометрическом уравнении суммарной каталитической реакции.
То, что катализатор не участвует в стехиометрическом уравнении реакций, не означает абсолютной неизменности его состава и свойств. Под влиянием реагентов, примесей, основных и побочных продуктов реакций, циркуляции и температуры катализатор всегда претерпевает физико-химические изменения. В этой связи в промышленных каталитических процессах предусматриваются операции замены, периодической или непрерывной регенерации катализатора.
Следующей важной особенностью катализа является специфичность действия катализатора. Нельзя рассматривать каталитическую активность как универсальное свойство катализатора. Многие катализаторы проявляют каталитическую активность в отношении одной или узкой группы реакций. Для каждой реакции целесообразно использовать свой наиболее активный и селективный катализатор
.
Классификация катализа и каталитических реакций.
По агрегатному состоянию реагирующих веществ и катализатора различают гомогенный катализ, когда реагенты и катализатор находятся в одной фазе, и гетерогенный катализ, когда каталитическая система включает несколько фаз. В нефтепереработке гетерогенный катализ, особенно с твердым катализатором, распространен значительно больше, чем гомогенный.
По природе промежуточного химического взаимодействия реагирующих веществ и катализатора катализ принято подразделять на следующие 3 класса: 1) гемолитический катализ - электронный, когда химическое взаимодействие протекает по гомолитическому механизму; 2) гетеролитический катализ – ионный, в случае гетеролитической природы промежуточного взаимодействия; 3) бифункциональный (сложный) катализ, включающий оба типа химического взаимодействия.
По гомолитическому, преимущественно так называемому электронному катализу протекают реакции окислительно-восстановительного типа (такой катализ поэтому часто называют окислительно-восстановительным): гидрирования, дегидрирования, гидрогенолиза гетероорганических соединений нефти, окисления и восстановления в производстве элементной серы, паровой конверсии углеводородов в производстве водорода, гидрировании окиси углерода до метана и др.
Каталитической активностью в отношении таких реакций обладают переходные металлы (с незаполненными d- или f- оболочками) первой подгруппы (Си, Ag) и восьмой группы (Fe, Ni, Co, Pt, Pd) периодической системы Д.И. Менделеева, их окислы и сульфиды, их смеси (молибдаты никеля, кобальта, ванадаты, вольфраматы, хроматы), а также карбонилы металлов и др.
Гетеролитический, или так называемый ионный катализ, имеет место в каталитических реакциях крекинга, изомеризации, циклизации, алкилирования, деалкилирования, полимеризации углеводородов, дегидратации спиртов, гидратации олефинов, гидролиза и многих других химических и нефтехимических процессах.
К катализаторам ионных реакций относятся жидкие и твердые кислоты и основания (по этому признаку гетеролитический катализ часто называют кислотно-основным): H2SO4, HF, HC1, Н3РО4, HNO3, СН3СООН, AICI3, BF3, SbF3, окислы аюминия, циркония, алюмосиликаты, цеолиты, ионообменные смолы, щелочи и др.
В техническом катализе (например, в процессах каталитического риформинга и гидрокрекинга) нашли широкое применение бифункциональные катализаторы, состоящие из носителя кислотного типа (окись алюминия, алюмосиликаты, промотированные галоидами, цеолитом и др.) с нанесенным на него металлом - катализатором гомолитических реакций (Pt, Pd, Co, Ni, Mo и др.).
Гетерогенные катализаторы. Под термином «гетерогенный катализатор» подразумевают обычно твердый катализатор, нашедший преимущественное применение в каталитических процессах химической технологии.
Гетерогенные катализаторы должны удовлетворять определенным требованиям технологии каталитического процесса, основные из которых следующие: 1) высокая каталитическая активность; 2) достаточно большая селективность (избирательность) в отношении целевой реакции; 3) высокая механическая прочность к сжатию, удару и истиранию; 4) достаточная стабильность всех свойств катализатора на протяжении его службы и способность к их восстановлению при том или ином методе регенерации; 5) простота получения, обеспечивающая воспроизводимость всех свойств катализатора; 6) оптимальные форма и геометрические размеры, обусловливающие гидродинамические характеристики реактора; 7) небольшие экономические затраты на производство катализатора. Обеспечение этих требований достигается главным образом при разработке состава и способа получения катализатора.
Активность катализатора определяется удельной скоростью данной каталитической реакции, то есть количеством продукта, образующегося в единицу времени на единицу объема катализатора или реактора.
В подавляющем большинстве случаев в присутствии данного катализатора, помимо основной реакции, протекает еще ряд побочных параллельных или последовательных реакций. Доля прореагировавших исходных веществ с образованием целевых продуктов характеризует селективность катализатора. Она зависит не только от природы катализатора, но и от параметров каталитического процесса, поэтому ее следует относить к определенным условиям проведения реакции. Селективность зависит также от термодинамического равновесия. В нефтепереработке иногда селективность условно выражают как отношение выходов целевого и побочного продуктов, например, как бензин/газ, бензин/кокс или бензин/газ +кокс.
Стабильность является одним из важнейших показателей качества катализатора, характеризующая его способность сохранять свою активность во времени. От нее зависят стабильность работы установок, продолжительность их межремонтного пробега, технологическое оформление, расход катализатора, материальные и экономические затраты, вопросы охраны окружающей среды и технико-экономические показатели процесса и др.
В процессе длительной эксплуатации катализаторы с определенной интенсивностью претерпевают физико-химические изменения, приводящие к снижению или потере их каталитической активности (иногда селективности), то есть катализаторы подвергаются физической и химической дезактивации.
Физическая дезактивация (спекание) катализатора происходит под воздействием высокой температуры (в некоторых каталитических процессах) и водяного пара и при его транспортировке и циркуляции. Этот процесс сопровождается снижением удельной поверхности как носителя (матрицы) катализатора, так и активного компонента (в результате рекристаллизации - коалесценции нанесенного металла с потерей дисперсности).
Химическая дезактивация катализатора обусловливается:
1) отравлением его активных центров содержащимися в сырье некоторыми примесями, называемыми ядом (например, сернистыми соединениями в случае алюмоплатиновых катализаторов реформинга);
2) блокировкой его активных центров углистыми отложениями (коксом) или металлоорганическими соединениями, содержащимися в нефтяном сырье.
В зависимости от того, восстанавливается или не восстанавливается каталитическая активность катализатора после регенерации, различают соответственно обратимую и необратимую дезактивации. Однако даже в случае обратимой дезактивации катализатор, в конечном счете «стареет» и приходится выгружать его из реактора.
Гетерогенные катализаторы редко применяются в виде индивидуальных веществ и, как правило, содержат носитель и различные добавки, получившие название модификаторов. Цели их введения разнообразны: повышение активности катализатора (промоторы), его избирательности и стабильности, улучшение механических и структурных свойств.
В смешанных катализаторах, где компоненты находятся в соизмеримых количествах (например, в алюмокобальт- или алюмоникель-молибденовых катализаторах процессов гидроочистки нефтяного сырья) могут образоваться новые, более активные соединения, обладающие специфическим каталитическим действием. Так, Со или Ni в отдельности обладают высокой де- и гидрирующей активностью, но исключительно чувствительны к отравляющему действию сернистых соединений. Мо в отношении этой реакции малоактивен, но обладает большим сродством к сернистым соединениям. Катализаторы, в которых одновременно присутствуют Мо и Со или Ni в оптимальных соотношениях, весьма эффективны в реакциях гидрогенолиза сернистых и других гетероорганических соединений нефтяного сырья.
Не менее важна роль носителей гетерогенных катализаторов, особенно в случае дорогостоящих металлических катализаторов (Pt, Pd, Ni, Co, Ag). Подбором носителя достигаются требуемые пористая структура, удельная поверхность, механическая прочность и термостойкость. В качестве носителей используют окиси алюминия, алюмосиликаты, окиси хрома или кремния, активированный уголь, пемзу, кизельгур и другие природные и синтетические материалы.
Как особый класс представляют цеолитсодержащие алюмосиликатные катализаторы крекинга нефтяного сырья, в которых главную роль играют кристаллические цеолиты, имеющие каркасную структуру с относительно большими сотообразными полостями, которые сообщаются окнами малых размеров так, что все полости связаны между собой. В 1 г цеолита имеется около 1020 полостей и 800 м2 поверхности, способной к ионному обмену на металлы. Цеолиты диспергируются в аморфной матрице, которая выполняет роль носителя с крупными порами, и при крекинге способствуют первичному распаду высокомолекулярного нефтяного сырья и тем самым готовит сырье для последующих вторичных реакций на цеолите.
Большое внимание на качество катализатора оказывает способ его получения. Поскольку каталитическая реакция протекает на поверхности, целесообразно получить катализатор с максимально развитой поверхностью с большим количеством пор. Для разных реакций оптимальными могут быть узкие или, наоборот, более широкие поры, а также их комбинации. Не менее важны форма и размер зерен катализатора - от этого зависят удельная производительность, гидравлическое сопротивление слоя катализатора и конструкция реакционных аппаратов (со стационарным, движущимся или псевдоожиженным слоем катализатора). Кроме того, сама активность единицы поверхности катализатора зависит не только от его химического состава, но и от способа его приготовления.
Адсорбция и катализ
В гетерогенном катализе на твердом катализаторе промежуточное химическое взаимодействие реактантов с катализатором осуществляется лишь на его доступной для молекул реагирующих веществ так называемой реакционной поверхности посредством адсорбции. Удельная реакционная поверхность гетерогенного катализатора определяется его пористой структурой, то есть количеством, размером и характером распределения пор.
Однако не всякая поверхность твердого тела обладает каталитической активностью. На поверхности одних веществ может происходить лишь физическая адсорбция, а других - хемосорбция с более прочной химической связью. Так, на поверхности активированного угля водород и азот могут адсорбироваться лишь физически, а кислород и при высоких температурах водяной пар подвергаются химической адсорбции и при их десорбции выделяются не О2 и Н2О, а продукты их хемосорбции в виде СО, СО2 и Н2. Это свидетельствует о том, что тип и прочность промежуточной (то есть поверхностной) химической связи обусловливается химическим строением твердого тела, а также сродством последнего по отношению к молекулам реактантов.
Адсорбция как физическая, так и химическая обусловливается избыточной свободной энергией поверхности. Если валентные связи между атомами и ионами, расположенными внутри объема твердого тела, взаимно скомпенсированы (насыщены), то таковой компенсированности межмолекулярных сил на его поверхности (как и на поверхности жидкости) не происходит. Кроме того, поверхность твердого тела не является идеально гладкой, а имеет многочисленные ультрамикроскопические выступы и углубления различных форм в зависимости от геометрии кристаллической решетки. Сама кристаллическая решетка также не всегда идеальна и однородна, и на ней имеются различного рода дефекты и примеси. Естественно, степень компенсированности валентных сил на различных участках неоднородной поверхности твердого тела различна и, следовательно, неоднородна адсорбционная активность этой поверхности. Наиболее активные участки (центры) поверхности будут более энергично адсорбировать (хемосорбировать) молекулы реактантов.
Энергетика и химическая природа катализа
В соответствии с современными физико-химическими представлениями о сущности катализа катализатор и реагирующие вещества следует рассматривать как единую каталитическую реакционную систему, в которой химические превращения испытывают не только реактанты под действием катализатора, но и катализатор при взаимодействии с реагентами. В результате такого взаимного воздействия в реакционной системе устанавливается стационарный состав поверхности катализатора, определяющий его каталитическую активность. Отсюда следует, что катализатор - не просто место осуществления реакции, а непосредственный участник химического взаимодействия, и его каталитическая активность обусловливается химической природой катализатора и его химическим сродством к реактантам.
Термодинамические и кинетические принципы катализа
- Катализатор должен химически взаимодействовать хотя бы с одним из компонентов реагирующих веществ.
- Соединения реагирующих веществ с катализатором должны быть термодинамически менее прочными, чем продукты реакции
- В кинетическом отношении каталитическая реакция будет идти с большей скоростью, если в результате промежуточного химического взаимодействия катализатор будет снижать энергию активации химической реакции
Ионный катализ.
Катализаторами в ионном (гетеролитическом) катализе являются кислоты и основания. Каталитическая активность кислот и оснований обусловливается способностью их к обмену реагирующей молекулой ионом или парой электронов с образованием промежуточного соединения ионного типа, обладающего высокой реакционной способностью.
В нефтепереработке принято называть образующиеся при взаимодействии углеводородов с кислотным катализатором первичное (промежуточное) соединение карбений ионом или карбкатионом, а катализ - соответственно карбений ионным.
Карбкатионы наиболее легко образуются при передаче протона кислотного катализатора к молекуле олефина, который может образоваться при термолизе углеводородов:
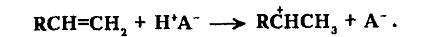
Надо отметить, что протон Н+ (гидрид-ион, гидрид-радикал Н-) характеризуется исключительно высокой реакционной способностью, что объясняется отсутствием у него электронной оболочки. Гидрид-ион — единственный катион, не имеющий электрона. Диаметр Н+ примерно в 104 раз меньше диаметра любого другого катиона.
Карбкатион, образующийся при взаимодействии протона с олефином, называют карбений ионом. При атаке протоном олефина π электроны двойной связи используются для образования новой т-связи между протоном и одним из углеродных атомов, образующим двойную связь, при этом второй углеродный атом углеводорода заряжается положительно.
При взаимодействии олефина с протоном возможно образование двух разных карбений ионов:
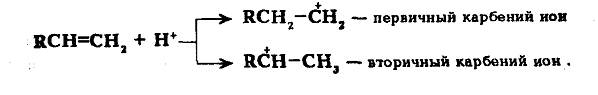
Расчеты показывают, что теплота образования первичных карбениевых ионов на 81 кДж/моль больше, чем для вторичных, и на 81+61 кДж/моль больше, чем для третичных. Вследствие этого первичные карбениевые ионы быстро переходят в третичные.
Образование карбкатиона возможно также непосредственно из алкана путем отщепления гидрид-иона под действием протонного центра или апротонного катализатора:
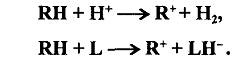
Карбениевые ионы являются высокоактивными частицами, вступающими во вторичные реакции с углеводородами с исключительно большой скоростью. Активность (константа скорости) карбений ионов на несколько порядков выше активности радикалов.
Основными реакциями карбкатионов, как и радикалов, являются мономолекулярный распад по β-правилу и бимолекулярные реакции замещения и присоединения. Существенное отличие карбкатионов от радикалов - способность первых к изомеризации, что объясняется значительным снижением свободной энергии при переходе от первичного к вторичному и третичному карбкатионам.
Электронный катализ
В электронном (окислительно-восстановительном) катализе ускоряющее действие катализаторов достигается облегчением электронных переходов в гомолитических реакциях за счет свободных электронов переходных металлов.
Переходные металлы являются активными катализаторами в подавляющем большинстве окислительно-восстановительных реакций. Железо, например, является классическим катализатором синтеза аммиака. Кобальт, никель, медь и металлы платиновой группы проявляют высокую активность в процессах гидрирования и дегидрирования, а также окисления. Серебро является практически единственным катализатором парциального окисления (например, этилена до его окиси).
Характерной особенностью переходных металлов является незавершенность их электронных d-оболочек, определяющая их специфические химические (переменная валентность, склонность к комплексообразованию), многие физические (образование кристаллов металлического типа, работа выхода электрона из металла, электропроводимость, магнитные свойства и др.) и каталитические свойства.
В кристаллическом состоянии часть электронов из d-оболочек переходит в зону проводимости и возникает возможность обмена электронами между d- и внешней s-оболочкой. Энергетическая легкость подобного перехода (определяемая работой выхода электрона из металла) приводит к тому, что на внешней поверхности кристалла образуется определенное число свободных электронов. Их наличие приводит к появлению на поверхности свободных валентностей -положительных в случае свободного электрона (электронно-донорная проводимость) и отрицательных при отсутствии электрона (электронно-акцепторная, так называемая «дырочная» проводимость) у частицы, расположенной на поверхности кристалла. Число свободных валентностей будет увеличиваться экспоненциально с ростом температуры.
- Наличие свободных валентностей на поверхности электронных катализаторов определяет, прежде всего, их адсорбционные (хемо-сорбционные) свойства. При этом возможны два различных механизма процесса хемосорбции.
- Поверхность катализатора обладает меньшим сродством к электрону адсорбирующегося атома или молекулы, как, например, хемосорбция кислорода на металлической поверхности. В этом случае возникает ковалентная связь за счет перехода свободных электронов из металла к кислороду (то есть кислород является окислителем).
- Поверхность металла обладает большим сродством к электрону, по сравнению со сродством к электрону адсорбирующегося атома. Типичный пример - хемосорбция водорода на металлической поверхности (например, платины). В этом случае происходит переход электрона от адсорбирующейся молекулы в металл (водород является восстановителем).
При определенных условиях одни и те же молекулы могут быть донорами или акцепторами электронов. Или же на поверхности катализатора могут иметь место одновременно оба типа механизма хемосорбции: на одних участках поверхность является донором, а на других—акцептором электронов.
Бифункциональный катализ имеет место в других промышленно важных процессах, в которых одни стадии сложной реакции протекают по ионному, а другие - электронному катализу. По такому ионно-электронному катализу осуществляются реакции ароматизации (дегидроциклизации) нормальных алканов и пятичленных нафтенов в процессе каталитического риформинга бензина, реакции деструктивного гидрирования в процессе гидрокрекинга, а также изомеризации С4-С6 алканов.
Естественно, катализаторы бифункционального катализа должны содержать в своем составе одновременно оба типа центров -и металлические (м.ц.), и кислотные (к.ц.). Так, полиметаллический алюмоплатиновый катализатор риформинга представляет собой платину, модифицированную редкоземельными металлами (например, Re), на носителе - окиси алюминия, промотированном кислотой (хлором). В катализаторе гидрокрекинга, например, алю-мокобальтмолибденцеолитовом (или алюмоникельмолибденцеолитовом), Со + Мо или Ni + Mo осуществляют гидрирующе-дегидрирующие функции, а цеолит является кислотным компонентом. В качестве примера приведем возможные схемы протекания подобных реакций:
1. Реакция дегидроциклизации нормального гексана:
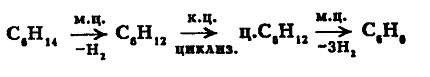
2. Реакции изомеризации н-бутана:
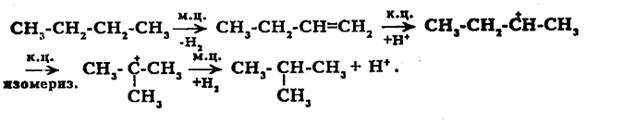
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2512; Нарушение авторских прав?; Мы поможем в написании вашей работы!