
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Взаимное влияние атомов в молекулах биоорганических соедиений. Электронные эффекты заместителей. Кислотные и основные свойства биоорганических молекул
|
|
|
|
ЛЕКЦИЯ 2
Содержание лекции.
2.1. Взаимное влияние атомов в молекулах биоорганических соединений
2.1.1. Электронные эффекты заместителей. Индуктивный и мезомерный эффект. Донорные и акцепторные группы-заместители.
2.1.2. Распределение электронной плотности в биоорганических молекулах.
2.2. Кислотно-основные свойства органических соединений.
2.2.1. Теория Бренстеда-Лоури. Определения «кислоты и основания» в соответствии с теорией Бренстеда-Лоури.
2.2.2. Биоорганические соединения- кислоты. Влияние типа кислотного центра и
заместителей кислотные свойства.
2.2.3. Биоорганические соединения- основания.. Влияние типа основного центра и
заместителей основные свойства. свойства
2.3.Медико- биологическое значение изучения темы «Кислотно-основные свойства биоорганических соединений»
Исходный уровень знаний для усвоения темы
Гибридизация орбиталей и пространственная ориентация орбиталей элементов 2 периода., виды химических связей, особенности образования ковалентных σ- и π –связей, полярные и неполярные ковалентные связи, изменение электроотрицательности элементов в периоде и группе, функциональные группы, сопряженные системы, делокализация.
2.1. Взаимное влияние атомов в молекулах биоорганических соединений.
Электронные эффекты заместителей
Ключевые слова к разделу 2.1.
Заместитель донорный, акцепторный, электроотрицательность, распределение электронной плотности в молекуле биоорганического соединения, эффект индуктивный, мезомерный
Смещение электронной плотности в биоорганических соединениях связано с различной электроотрицательностью атомов. Электронная плотность смещается всегда в сторону более электроотрицательного атома.
Ряд электроотрицательности:
F > O > N > C1 > Br > I ~ S > C > H
Функциональные группы, смещающие электронную плотность в свою сторону, являются акцепторами, а группы, «отталкивающие» от себя электронную плотность- донорами.
Для демонстрации этих явлений составляют диаграммы распределения электронной плотности, которые помогают понять направление органической реакции и объяснить, почему они именно так протекают, а не иначе. На основании распределения электронной плотности можно высказать предположение о механизме реакции и строении образующихся веществ.
Смещение электронной плотности вдоль σ –связей носит название индуктивного эффекта Атомы или функциональные группы, «отталкивающие» от себя электронную плотность, проявляют положительный (+I) а смещающие в свою сторону – отрицательный (- I) эффекты.
Индуктивный эффект обозначают стрелкой вдоль связи, которая направлена от атома с частичным положительным зарядом (б +) в сторону того атома, на котором возникает избыточный отрицательный заряд (частичный заряд б-)
Индуктивный эффект распространяется на соседние 2-3 атома по отношению к группе, вызывающей этот эффект, и по мере удаления от группы убывает.
Пример:
Распределение электронной плотности в молекуле бутановой кислоты.
б + б + б +
СН3 —> СН2 —> СН2—>СН2 —>СООН
<—————— заряд б + убывает по направлению стрелки
Смещение электронной плотности в системе сопряженных связей носит название мезомерного эффекта (М-эффект). Мезомерный эффект охватывает всюациклическую сопряженную систему, частичные заряды возникают на крайних атомах в сопряженной системе, а в бензольном кольце – изменение электронной плотности происходит в положениях 2,4,6 (по отношению к группе, проявляющей эффект).
Атомы галогенов, гидрокси- и аминогруппы содержат неподеленные пары электронов, которые смещаются в сторону π -связи, образуя общую сопряженную систему. Они проявляют +М-эффект. Карбоксильная, карбонильная, нитро-группы обладают –М-эффектом, и они смещают π-электронную плотность в свою сторону.
Примеры: пропеновая (акриловая) кислота
б+ 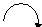
 б-
б-
СН2 == СН— С ==О
\
ОН
Хлорвинил (хлорэтен)
б+ 
 б-
б-
С1 —СН ==СН2
Если в ароматической системе бензола присутствует заместитель – донор, то возникает частичный(избыточный) заряд δ- в положениях 2,4,6 Донорными группами. Проявляющими положительный мезомерный эффект, следует считать гидрокси, амино группы, атомы галогенов фтора и хлора.
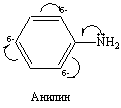
– если заместитель – акцептор, то частичный заряд δ+ в положениях 2,4,6


Акцепторные группы: карбоксильная, альдегидная., нитро, циано.
Донор проявляет положительные + I и + М –эффекты, а акцептор - отрицательные - I и – М –эффекты.
В сопряженной системе главным считается мезомерный М-эффект.
Атом азота в шестичленных ароматических гетероциклических соединениях пиридине и пиримидине имеет отрицательный мезомерный эффект, поэтому снижается общая электронная плотность в ароматической системе(вспомните понятие π-недостаточные циклы) и по отношению к атому азота в положениях 2, 4, 6 цикла возникает недостаток электронной плотности и появляется частичный заряд б +. В никотиновой кислоте введение карбоксильной группы в молекулу пиридина увеличивает недостаток электронной плотности. Атом азота и карбоксильная группа действуют «согласованно» и создают недостаток электронной плотности в одних и тех же положениях 2,4,6 по отношению к ним.
δ+
δ+
δ+ 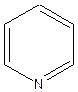 δ+
..
Пиридин
\ δ+
..
Пиридин
\
| δ+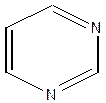 δ+
..
Пиримидин δ+
..
Пиримидин
|
δ +
δ +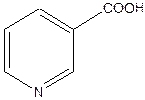
Никотиновая кислота
В таблице представлены значения(направления) эффектов функциональных групп.
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1887; Нарушение авторских прав?; Мы поможем в написании вашей работы!