
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчеты концентраций реагентов и продуктов реакции, скоростей реакции
|
|
|
|
В ходе реакции 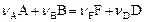 концентрации реагентов
концентрации реагентов 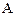 и
и 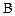 уменьшаются, а концентрации продуктов
уменьшаются, а концентрации продуктов 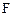 и
и 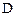 увеличиваются по сравнению с первоначальными значениями
увеличиваются по сравнению с первоначальными значениями 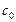 и в некоторый момент времени
и в некоторый момент времени 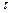 равны:
равны:
| для реагентов | для продуктов | ||
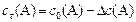 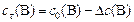
| 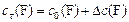
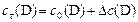
| ||
С0(В) – исходная концентрация веществ, моль/л
Сt(В) – концентрация веществ к моменту времени t, моль/л
DС(В) – прореагировало (вступило в реакцию) регентов или образовалось продуктов за отрезок времени Dt, моль/л
Как правило, в начальный момент времени концентрации продуктов реакции 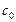 равны нулю
равны нулю 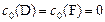 .
.
Изменения концентраций 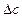 для каждого вещества-участника реакции связаны со стехиометрическими коэффициентами в уравнении реакции:
для каждого вещества-участника реакции связаны со стехиометрическими коэффициентами в уравнении реакции:
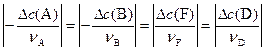
Если известно значение DС для одного вещества, участвующего в химической реакции, то можно рассчитать DС для всех остальных веществ.
В соответствии с выше изложенным различают скорости реакции:  – начальную и
– начальную и 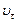 – в любой момент времени.
– в любой момент времени.
Таблица
| Скорость | Реакции | |
| прямая | обратная | |
начальная, 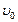
| 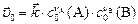
| 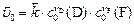
|
в момент 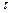 , , 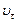
| 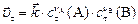
| 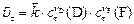
|
Используя уравнения (10 - 12) и таблицу 2, можно рассчитать концентрации и скорости реакций в любой момент времени.
Пример 1. Для гомогенной газофазной реакции
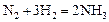
определить: а) как изменится скорость прямой реакции, если концентрацию азота уменьшить в 2 раза, а концентрацию водорода увеличить в 2 раза; б) давление в системе увеличить в 3 раза.
Решение. а) Согласно закону действующих масс, скорость прямой химической реакции описывается уравнением
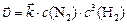 .
.
После изменения концентрации реагентов будут равны
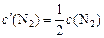 ;
; 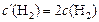 , тогда
, тогда
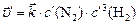 , или
, или
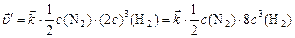 .
.
Изменение скорости прямой реакции по отношению к первоначальной:
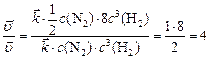 ,
,
т. е. скорость прямой реакции увеличится в 4 раза.
б) Из уравнения состояния газов (уравнение Менделеева-Клапейрона)
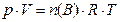 (8)
(8)
следует:
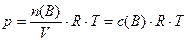 , (9)
, (9)
что 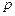 (при
(при 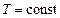 ) прямо пропорционально молярной концентрации газообразных веществ.
) прямо пропорционально молярной концентрации газообразных веществ.
Следовательно, увеличение (или уменьшение) давления в системе в 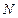 раз приводит соответственно к увеличению (или уменьшению) концентрации всех газов-участников реакции также в
раз приводит соответственно к увеличению (или уменьшению) концентрации всех газов-участников реакции также в 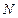 раз.
раз.
Тогда по условию задачи при увеличении давления в 3 раза новые концентрации веществ (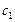 ):
):
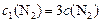 ;
; 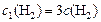 ,
,
тогда 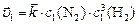 или
или
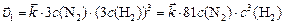 ,
,
откуда: 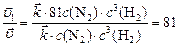 ,
,
т. е. скорость прямой реакции увеличится в 81 раз.
Пример 2. Для реакции  определите: а) как был изменен объем системы, если скорость прямой реакции уменьшилась в 4 раза? б) как при этом изменилась скорость обратной реакции?
определите: а) как был изменен объем системы, если скорость прямой реакции уменьшилась в 4 раза? б) как при этом изменилась скорость обратной реакции?
Решение. а) Прямая реакция гетерогенная, углерод  не учитывается в законе действующих масс, поэтому:
не учитывается в законе действующих масс, поэтому: 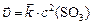 , или, учитывая (2):
, или, учитывая (2): 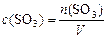 , получаем:
, получаем:
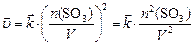 .
.
Обозначим новый объем 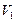 ; так как количество
; так как количество 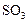 в системе не меняется, то
в системе не меняется, то 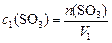 , и
, и
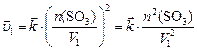
По условию задачи 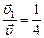 , откуда
, откуда
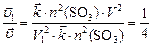 ;
;
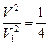 или
или 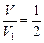 , т. е.
, т. е. 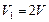 .
.
Следовательно, объем системы увеличился в 2 раза (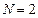 ).
).
б) Поскольку молярная концентрация вещества обратно пропорциональна объему системы (уравнение 2), то при увеличении объема в 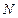 раз концентрации газообразных и растворенных веществ уменьшаются в
раз концентрации газообразных и растворенных веществ уменьшаются в 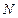 раз, а при уменьшении объема системы в
раз, а при уменьшении объема системы в 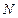 раз концентрации этих веществ увеличиваются в
раз концентрации этих веществ увеличиваются в 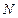 раз.
раз.
Если объем системы увеличился в 2 раза, то для обратной гомогенной реакции закон действующих масс запишется:
до изменения объема: 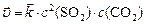 ;
;
после увеличения объема в 2 раза:
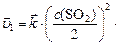
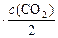 . И тогда соотношение:
. И тогда соотношение:
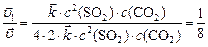
Скорость обратной реакции уменьшилась в 8 раз.
Пример 3. Начальные концентрации реагентов газофазной реакции
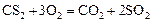
равны (моль/л): 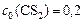 ;
; 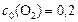 . Рассчитать: а) во сколько раз по сравнению с первоначальной изменится скорость прямой реакции в тот момент, когда прореагирует 20% сероуглерода. б) скорость обратной реакции в этот момент времени, если
. Рассчитать: а) во сколько раз по сравнению с первоначальной изменится скорость прямой реакции в тот момент, когда прореагирует 20% сероуглерода. б) скорость обратной реакции в этот момент времени, если 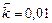 моль-2·л2·с-1.
моль-2·л2·с-1.
Решение. Для наглядности внесем исходные данные в таблицу.
Таблица 3
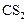 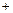 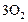 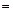 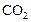 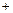 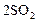
| ||||
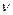 , моль , моль
| ||||
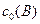 , моль/л , моль/л
| 0,2 | 0,2 | ||
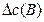 , моль/л , моль/л
| ||||
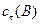 , моль/л , моль/л
| ||||
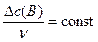
|
По мере определения указанных в таблице величин будем вносить их значения в таблицу. Значения обозначаем *.
Для ответа на поставленные в задаче вопросы необходимо рассчитать:
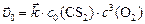
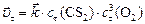
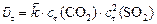
или:
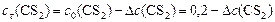
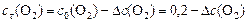
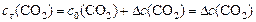
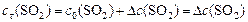 , т. к.
, т. к. 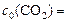
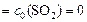 .
.
Задача сводится в основном к определению изменения концентраций веществ, участвующих в реакции.
По условию задачи прореагировало 20% 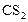 . Чтобы определить
. Чтобы определить 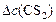 , составляем пропорцию:
, составляем пропорцию:
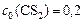 моль/л моль/л
| – | 100% |
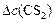
| – | 20%, |
откуда
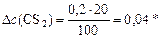 моль/л.
моль/л.
Находим 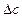 - изменение концентрации реагентов и продуктов в ходе реакции, используя соотношение ().
- изменение концентрации реагентов и продуктов в ходе реакции, используя соотношение ().
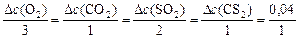 ,
,
откуда:
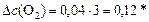 моль/л;
моль/л;
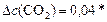 моль/л;
моль/л;
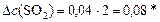 моль/л.
моль/л.
Вычисляем концентрации реагентов и продуктов в момент времени 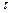 :
:
Реагенты:
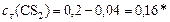 моль/л.
моль/л.
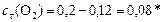 моль/л.
моль/л.
Продукты:
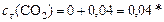 моль/л.
моль/л.
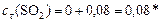 моль/л.
моль/л.
Ниже представлен окончательный вариант таблицы 3 с результатами расчетов.
Таблица 4
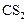 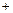 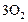 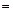 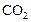 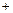 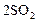
| ||||
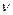
| ||||
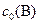 , моль/л , моль/л
| 0,2 | 0,2 | ||
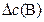 , моль/л , моль/л
| 0,04 | 0,12 | 0,04 | 0,08 |
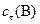 , моль/л , моль/л
| 0,16 | 0,08 | 0,04 | 0,08 |
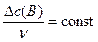
| 0,04 | 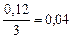
| 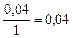
| 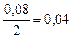
|
а) Вычисляем, во сколько раз изменится скорость прямой реакции в момент времени 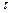 по сравнению с первоначальной.
по сравнению с первоначальной.
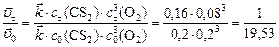 .
.
Итак, скорость прямой реакции уменьшится в 19,53 раза.
б) Рассчитаем скорость обратной реакции
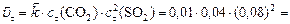
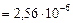
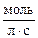 .
.
Пример 4. Начальная концентрация оксида азота (I) в реакции
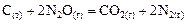
составляет 0,7 моль/л, константа скорости прямой реакции 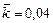 . Определить скорость прямой реакции в тот момент времени, когда образовалось 0,3 моль/л диоксида углерода; массовую долю прореагировавшего оксида азота (I), а также концентрацию образовавшегося азота в этот момент.
. Определить скорость прямой реакции в тот момент времени, когда образовалось 0,3 моль/л диоксида углерода; массовую долю прореагировавшего оксида азота (I), а также концентрацию образовавшегося азота в этот момент.
Решение. Для решения задачи необходимо: а) рассчитать скорость прямой гетерогенной реакции в момент 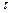 :
: 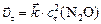 ; б) концентрацию продукта реакции (
; б) концентрацию продукта реакции (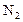 ) в момент
) в момент 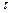 :
: 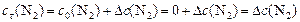 ; в) массовую долю прореагировавшего диоксида углерода (
; в) массовую долю прореагировавшего диоксида углерода (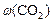 ).
).
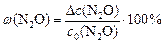
По условию задачи
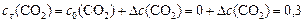 моль/л;
моль/л;
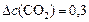 моль/л.
моль/л.
Тогда, пользуясь соотношением
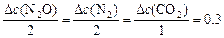 ,
,
определяем:
а) 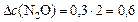 моль/л;
моль/л; 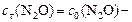
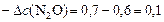 моль/л.
моль/л.
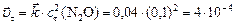
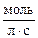 .
.
б) 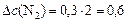 моль/л.
моль/л.
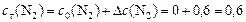 моль/л.
моль/л.
в) 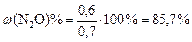 .
.
Пример 5. Константа скорости гомогенной реакции
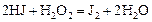
равна 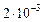 . Через некоторое время от начала реакции в реакционной смеси обнаружено 20 % от первоначального количества HJ, 0,2 моль/л
. Через некоторое время от начала реакции в реакционной смеси обнаружено 20 % от первоначального количества HJ, 0,2 моль/л 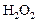 и 0,4 моль/л
и 0,4 моль/л 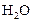 . Рассчитать концентрацию
. Рассчитать концентрацию 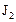 в этот момент и начальную скорость прямой реакции.
в этот момент и начальную скорость прямой реакции.
Решение. Известна концентрация одного из продуктов реакции – 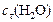 , что позволяет вычислить изменение концентрации
, что позволяет вычислить изменение концентрации 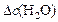 к моменту времени
к моменту времени 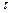 :
:
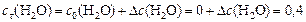 моль/л;
моль/л;
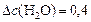 моль/л.
моль/л.
Тогда, пользуясь соотношением
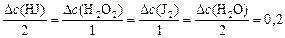 ,
,
определяем:
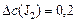 (моль/л);
(моль/л);
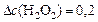 (моль/л);
(моль/л);
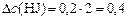 (моль/л).
(моль/л).
Искомая концентрация 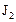 в момент времени
в момент времени 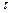 :
:
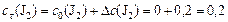 моль/л;
моль/л;
Находим начальные концентрации реагентов.
Поскольку 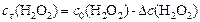 , то
, то
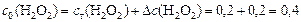 моль/л.
моль/л.
О втором реагенте (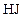 ) известно, что в реакционной смеси обнаружено (
) известно, что в реакционной смеси обнаружено (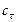 ) 20 % от первоначального количества; значит, прореагировало (
) 20 % от первоначального количества; значит, прореагировало (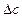 ) 80 %. Составляем пропорцию:
) 80 %. Составляем пропорцию:
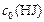
| – | 100% |
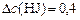 моль/л моль/л
| – | 80%, |
откуда
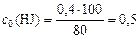 (моль/л).
(моль/л).
Результаты расчетов представим в виде таблицы 5.
Таблица 5
  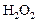  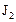  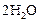
| ||||
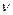
| ||||
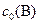 , моль/л , моль/л
| 0,5 | 0,4 | ||
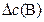 , моль/л , моль/л
| 0,4 | 0,2 | 0,2 | 0,4 |
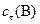 , моль/л , моль/л
| 0,1 | 0,2 | 0,2 | 0,4 |
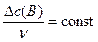
| 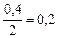
| 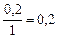
| 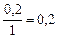
| 0,2 |
Начальную скорость прямой реакции рассчитываем по закону действующих масс:
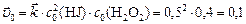
 .
.
Пример 6. В результате протекания реакции
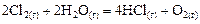
к некоторому моменту времени в реакционном сосуде объемом 5 л образовалось 71 г 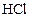 , осталось 0,4 моль
, осталось 0,4 моль 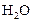 , а хлора прореагировало в 2 раза больше, чем осталось. Рассчитать концентрацию образовавшегося кислорода и скорость прямой реакции, если
, а хлора прореагировало в 2 раза больше, чем осталось. Рассчитать концентрацию образовавшегося кислорода и скорость прямой реакции, если 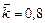 .
.
Решение. Вычислим концентрацию продуктов реакции:
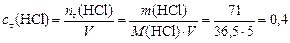 моль/л.
моль/л.
Поскольку 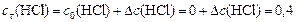 моль/л,
моль/л,
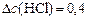 моль/л.
моль/л.
Тогда, пользуясь соотношением
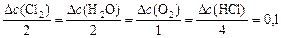 ,
,
определяем:
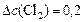 моль/л;
моль/л;
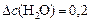 моль/л;
моль/л;
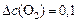 моль/л.
моль/л.
Искомая концентрация кислорода в момент времени 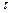 :
:
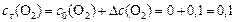 моль/л.
моль/л.
Находим начальные концентрации реагентов. Для этого сначала определяем концентрацию воды в момент времени 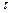 :
:
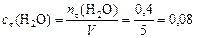 моль/л,
моль/л,
Поскольку 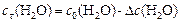 , то начальная концентрация воды
, то начальная концентрация воды
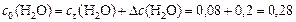 моль/л.
моль/л.
По условию задачи, хлора прореагировало в 2 раза больше, чем осталось:
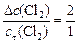 ,
,
откуда концентрация хлора в момент времени 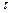 :
:
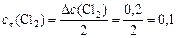 моль/л.
моль/л.
Учитывая, что 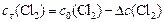 , определяем начальную концентрацию хлора:
, определяем начальную концентрацию хлора:
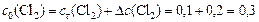 моль/л.
моль/л.
Результаты расчетов представим в виде таблицы 6.
Таблица 6
   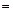 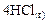 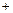 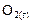
| ||||
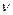
| ||||
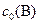 , моль/л , моль/л
| 0,3 | 0,28 | ||
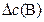 , моль/л , моль/л
| 0,2 | 0,2 | 0,4 | 0,1 |
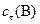 , моль/л , моль/л
| 0,1 | 0,08 | 0,4 | 0,1 |
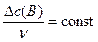
| 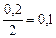
| 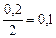
| 0,1 | 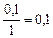
|
Рассчитываем скорость прямой реакции в начальный момент времени:
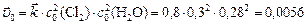
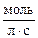 ;
;
скорость прямой реакции в момент времени 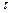 :
:
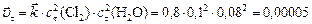
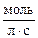 .
.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 8028; Нарушение авторских прав?; Мы поможем в написании вашей работы!