
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства газов
|
|
|
|
Тема 2. ФИЗИЧЕСКИЕ ОСНОВЫ ГОРЕНИЯ.
Основное уравнение кинетической теории газов имеет вид:
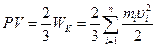 , (2.1)
, (2.1)
где: WK – суммарная кинетическая энергия поступательного движе-
ния n молекул газа, находящегося в объеме V;
mi, ui – масса и скорость движения i-той молекулы.
В результате беспорядочного движения и соударений газа происходит изменение скорости и энергий частиц. Возникают явления направленного пе-реноса внутренней энергии, т.е. теплопроводность, и переноса массы частиц, – диффузия с выравниванием того и другого в объеме вещества.
Теплопроводность возникает в веществе при наличии градиента тем-ператур:
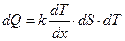 , (2.2)
, (2.2)
где: dQ – количество теплоты переносимой за время dT через поверх-ность dS по направлению нормали Х к этой поверхности в сторо-ну убывания температуры;
(dT/dх) – градиент температуры;
k – коэффициент теплопроводности, равный количеству теплоты, перенесенный через единицу поверхности за единицу времени при градиенте dT/dх =1.
Согласно кинетической теории газов:
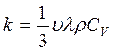 , Дж/(см×сек×град) (2.3)
, Дж/(см×сек×град) (2.3)
где: υ – средняя скорость теплового движения молекул;
l - средняя длина свободного пробега молекул;
r - плотность газа;
CV – удельная теплоемкость газа при постоянном объеме.
Диффузией называется процесс установления внутри фаз какой-то сис-темы равномерного распределения концентрации газа.
Фазой называется совокупность всех гомогенных частей системы. В гомогенной системе нет поверхностей раздела фаз (например, газовая фаза, раствор, твердая фаза), т.е. фаза находится в одном агрегатном состоянии. Система, состоящая из двух и более фаз, называется гетерогенной.
В двухкомпонентной системе явление диффузии описывается законом Фика:
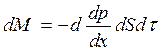 , (2.4)
, (2.4)
где: dM – масса первого компонента, которая переносится за время dt через площадь dS в направлении нормали Х к этой площадке в сторону убывания плотности первого компонента;
dr/dx – градиент плотности;
d – коэффициент диффузии.
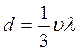 , см2/сек. (2.5)
, см2/сек. (2.5)
Теплоемкостью называется количество тепла, необходимое для повы-шения температуры вещества на один градус:
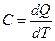 , Дж/(г×К) (2.6)
, Дж/(г×К) (2.6)
Различают CP – теплоемкость при P=const и CV – теплоемкость при V=const, которые объединяются соотношением:
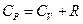 , (2.7)
, (2.7)
где: R – универсальная газовая постоянная, равная работе, совершае-мой 1 молем идеального газа при изобарном нагреве P=const на 1 градус:
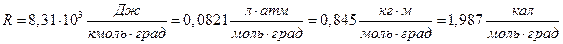 .
.
Понятия «моль», «R» вытекают из основных законов идеальных газов (идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом).
Кроме закона Бойля-Мариотта это следующие законы:
1. Закон Авогадро: Равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул.
Различие в массах веществ определяется разными весами их атомов и молекул. За единицу массы в молекулярной теории принят моль (г-молеку-ла). 1 моль – такая масса химически однородного вещества, которая (в грам-мах) численно равна его молекулярному весу.
Иногда закон Авогадро гласит так: «При одинаковых давлениях и тем-пературах грамм-молекулы различных идеальных газов имеют одинаковые объемы».
Число Авогадро: в 1 моле газа содержится 6,02×1023 молекул. Тогда 1 моль любого газа при 0 оС и 101,3 кПа занимает объем 22,414 л.
Другими словами, молекулярный вес – это вес 6,02×1023 молекул газа, выраженный в граммах. Тогда PV=22,4 л×атм/моль при 0 0С.
Например: атомный вес кислорода – 16. Молекулярный вес 16´2=32 г. Тогда в 32 г О2 содержится 6,02×1023 молекул О2.
Можно рассчитать удельный вес (плотность) газа при нормальных фи-зических условиях:
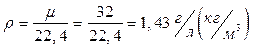 .
.
где: m - молекулярный вес газа.
2. Закон Гей-Люссака: при P=const объем массы газа прямо пропорцио-нален его абсолютной температуре:
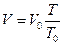 , (2.8)
, (2.8)
где: Т0=273 К;
V0 – объем газа при Т0.
3. Закон Шарля: при V=const давление данной массы газа прямо про-порционально его абсолютной температуре:
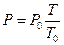 , (2.9)
, (2.9)
где: P0 – давление при Т0=273 К.
4. Уравнение состояния идеального газа для 1 моля газа:
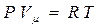 , (2.10)
, (2.10)
где: P, Vμ и T – давление, молекулярный объем и абсолютная темпе-
ратура газа.
5.Уравнение Менделеева-Клайперона для произвольной массы газа (М):
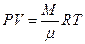 , (2.11)
, (2.11)
Связь ТГВ с рассмотренными законами и свойствами газов можно показать на следующих примерах.
1. Горение представляет собой комплекс взаимосвязанных физических и химических процессов. Важнейшими из них при горении являются тепло- и массоперенос. Наиболее общим свойством горения является способность возникшего очага (фронта) пламени перемещаться по горючей смеси путем теплопроводности и диффузии активных частиц из зоны горения в свежую смесь. Таким образом, скорость распространения пламени при горении и взрыве зависит от теплопроводности реагирующих веществ. С увеличением теплопроводности скорость горения возрастает.
2. Теплоемкость учитывается в термодинамических расчетах горения и выборе огнетушащих средств. Этот параметр относится как к физике, так и к термохимии, т.к. горение – это химическая реакция. Зависимость теплоемко-сти от температуры веществ выражается уравнением:
CP =a+bT+cT2, (2.12)
где: а, b, c – термодинамические константы.
3. R входит во все уравнения ТГВ.
4. Диффузия объясняет возникновение и протекание так называемого диффузионного горения.
5. На базе основных законов идеальных газов выведены постулаты тео-рии горения и самовоспламенения.
6. Законы идеальных газов являются основой расчетов давления, объе-ма, температуры в процессах горения и взрыва.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 423; Нарушение авторских прав?; Мы поможем в написании вашей работы!