
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетические основы газовых реакций
|
|
|
|
По закону действующих масс скорость реакции при постоянной темпе-ратуре пропорциональна концентрации реагирующих веществ или, как гово-рят, «действующих масс».
Скоростью химической реакции (υ) принято считать количество веще-ства, реагирующего в единицу времени (dt) в единице объема (dV).
Рассмотрим реакцию, протекающую по уравнению:
А + В = С + Д.
Поскольку скорость реакции характеризует уменьшение во времени концентрации реагирующих веществ и увеличение концентрации продуктов реакции, то можно записать:
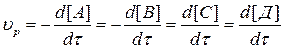 , (3.1)
, (3.1)
где минусы при производных говорят о направлении изменения концентра-ции компонентов, а в квадратных скобках указаны концентрации компонен-тов.
Тогда прямая необратимая реакция при Т = const протекает со скоро-стью:
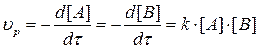 , (3.2)
, (3.2)
где: k – константа скорости химической реакции. Она не зависит от концентрации компонентов, а изменяется только с температурой.
По закону действующих масс концентрации компонентов реакции вхо-дят в кинетическое уравнение в степени, равной стехиометрическому коэф-фициенту этого компонента.
Так, для реакции
аА + bB = cC + dД
Кинетическое уравнение имеет вид:
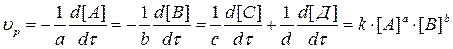 … (3.3)
… (3.3)
Показатели степеней a, b, c, d принято называть порядками реакции по компонентам А, В, С, Д, а сумму показателей – общим порядком реакции.
Например, реакции типа
А ® bB + cC – I порядка,
2А = bB + cC – II порядка,
А + B = cC + dД – III порядка.
Поскольку концентрации всех реагирующих компонентов связаны ме-жду собой стехиометрическими уравнениями, то простейшие кинетические уравнения I порядка являются дифференциальными уравнениями I порядка с одной независимой переменной – концентрацией – и могут быть проинтегри-рованы.
Простейшим кинетическим уравнением является уравнение I порядка типа
А=bB+cC…,
для которого 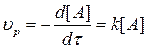 . (3.4)
. (3.4)
Обозначим через [A0] концентрацию компонента А до начала реакции и, проинтегрировав уравнение при граничном условии t=0, [А]=[А0], получа-ем:
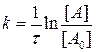 , или [A]=[A0]×e-kt. (3.5)
, или [A]=[A0]×e-kt. (3.5)
Таким образом, зависимость скорости реакции от концентрации ве-ществ имеет экспоненциальный характер.
Кинетическая энергия газов объясняет это так. По гипотезе Аррениуса реакция между молекулами проходит лишь в том случае, если они являются активными, т.е. обладают избыточной энергией, достаточной для разрыва межатомных связей, так называемой энергией активации ЕА.
Т.е. скорость химической реакции зависит не от количества столкнове-ний всех молекул, а только активированных.
По закону Больцмана, число активных молекул
nA = nо * e-E/RT, (3.6)
где: Е – энергия активации,
Т – температура газовой смеси,
nо – общее число молекул.
Тогда и число эффективных соударений, совпадающее со скоростью реакции, равно:
υр = Zэфф = Z0 * e-E/RT, (3.7)
где: Z0 – общее число соударений молекул.
Итак:
1) скорость реакции пропорциональна концентрации активных моле-кул, число которых зависит от температуры и давления в смеси, так как дав-ление и есть количество молекул, сталкивающихся с какой-либо поверхно-стью;
2) реакция возможна лишь в том случае, если взаимодействующие мо-лекулы получают определенный запас энергии, достаточный для разрыва или ослабления межатомных связей. Активация заключается в переходе молекул в такое состояние, в котором возможно химическое превращение.
Чаще всего процесс активации идет путем образования промежуточных неустойчивых, но высокоактивных соединений атомов.
Таким образом, не только для протекания эндотермических процессов нужен внешний подвод энергии, но и для экзотермических. Чтобы произош-ла экзотермическая реакция, надо сообщить ей какой-то импульс тепловой энергии. Например, для протекания реакции горения в смеси водорода с ки-слородом, надо ее поджечь.
Минимальное количество тепловой энергии, необходимое для «запус-ка» химической реакции, называется энергией активации.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 880; Нарушение авторских прав?; Мы поможем в написании вашей работы!