КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости
|
|
|
|
Лекция11. Свойства растворов электролитов. Степень диссоциации электролитов. Механизм диссоциации. Диссоциация слабых электролитов. Электролитическая диссоциация воды. Константа ионного произведения воды. Водородный показатель. Диссоциация сильных электролитов. Активность. Кажущаяся степень диссоциации. Условия необратимого протекания реакций между электролитами. Произведение растворимости. Гидролиз солей. Диссоциация комплексных соединений.
Задачи
1. Как изменится скорость прямой гомогенной реакции 2А+2В=С+2D, если давление в системе увеличить в два раза?
2. Температурный коэффициент скорости некоторой реакции равен 2. Во сколько раз увеличится скорость этой реакции, если температуру повысить на 20 0С?
3. Составить выражение для константы равновесия реакции 2HBr(г)=H2(г)+Br2(г). Как необходимо изменить внешние факторы (температуру, давление, концентрацию исходного вещества), чтобы сместить равновесие реакции в сторону образования продуктов реакции? Тепловой эффект прямой реакции рассчитать в соответствии с законом Гесса.
Ответы
Лекция 10. Растворы. Свойства р астворов
Понятие о растворах. Способы выражения количественного состава растворов. Закон эквивалентов для реакций в растворах. Основные законы растворов: законы Рауля и Вант – Гоффа. Особенности применения этих законов для растворов электролитов. Теория С. Аррениуса.
10.1. Понятие о растворах. Способы выражения количественного состава растворов Раствором называется твердая или жидкая гомогенная (однородная) система, состоящая из двух или более компонентов. Необходимыми компонентами раствора являются растворитель и растворенное вещество, например, растворенный в воде сахар. В одном растворителе может находиться несколько растворенных веществ. Например, в воде растворены сахар, соль и уксусная кислота. Количество растворенного вещества в определенном количестве раствора или растворителя, которое может колебаться в очень широких пределах, называется концентрацией раствора. Существует несколько способов выражения концентрации растворов.
 Х – концентрация
Х – концентрация 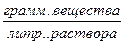 Y – концентрация
Y – концентрация 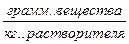
g – процентная концентрация 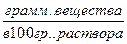
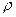 - плотность
- плотность 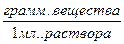
1мл.=1см3
С, СМ, М – молярность 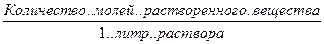
Сэ, Н – нормальность 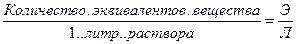
Сm,m – моляльность 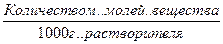
Т – титр 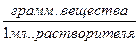
N – мольная доля 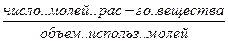
Виды растворов:
- Разбавленные (малой концентрации)
- Концентрированные (большой концентрации)
- Насыщенные (предельно допустимая концентрация)
Пересыщенные (концентрация больше предельно допустимой, такие растворы неравновесные)
Пример 1. Какую массу воды нужно прибавить к 200мл 15% раствора Н2SO4 (r=1,11 г/мл), чтобы получить 10%-ный раствор? Какова нормальность исходного раствора?
Решение. масса 200мл 15%-ного раствора Н2SO4 равна 200×1,11=222г. В этом растворе содержится 15% Н2SO4 т.е. 222×0,15=33,3г.
1. По условию задачи эта масса составит 10% от общей массы
разбавленного раствора. Тогда масса полученного раствора будет равна
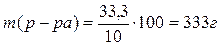 .
.
2. Следовательно, к исходному раствору необходимо добавить воды
mH2O = mр2-ра - m1 р-ра = 333-222=111г.
3. По определению, нормальность раствора равна количеству эквивалентов Н2SО4 в 1л раствора:
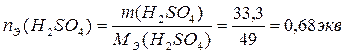 ,
,
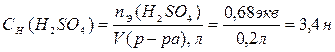 .
.
Таким образом, нормальность исходного раствора равна 3,4 экв/л.
Ответ: m(Н2О)=111 г; СН=3,4 н.
Закон эквивалентов для растворов. Если два раствора взаимодействуют между собой в эквивалентных количествах, то зная концентрацию одного из растворов и прореагировавшие объемы обоих растворов, можно рассчитать неизвестную концентрацию второго раствора по соотношению: 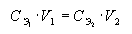 .
.
2. Основные законы растворов: законы Рауля и Вант – Гоффа. Эти законы являются коллигативными, то – есть зависят не только от концентрации растворов, но и от количества частиц в них.
I закон Рауля Относительное понижение давления паров растворителя над раствором (D р) равно мольной доле растворенного вещества.
D p= p0-p1= p0 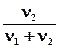 , (6.1)
, (6.1)
где р1 – парциальное давление насыщенного пара растворителя над раствором; р0 – давление насыщенного пара над чистым растворителем;
n1 – количество растворителя; n2 – количество растворенного вещества.
II закон Рауля При растворении вещества расширяется температурный интервал существования жидкой фазы растворителя вследствие смещения его температуры кристаллизации (замерзания) в низкотемпературную область, а температуры кипения – в высокотемпературную):
D Тф.п. = К× Сm, (6.2)
где D Тф.п. – изменение температуры фазового перехода (кристаллизации или кипения), К – коэффициент пропорциональности, зависящий от свойств растворителя; для кристаллизации – криоскопическая константа (Кк), для кипения – эбуллиоскопическая константа (Кэ). Для наболее распространенного растворителя-воды эти константы равны: Кк = 1,86К/моль, Кэ = 0,52К/моль.
С т – моляльная концентрация растворенного вещества.
3. Закон Вант-Гоффа:
Закон Вант – Гоффа определяет величину осмотического давления раствора. Чтобы ознакомиться с понятием осмоса, рассмотрим сосуд, разделённый на две части полупроницаемой мембраной. Полупроницаемая мембрана – перегородка, через которую проникают молекулы растворителя, но не проходят частицы растворённого вещества.
Осмос представляет собой самопроизвольное одностороннее перемещение молекул растворителя через полупроницаемую мембрану из той части системы, где концентрация растворителя выше, в ту часть системы, где его концентрация ниже.
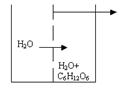 Определение осмотического давления растворов производится следующим образом. Во внешний сосуд наливается чистая вода, стенки внутреннего сосуда представляют собой полупроницаемую мембрану. Внутренний сосуд снабжен оттянутой горловиной и мерительной линейкой. Во внутреннем сосуде находится какой - либо раствор, например, сахара. В силу осмоса молекулы воды из внешнего сосуда через полупроницаемые стенки будут проходить во внутренний, движение молекул в этом приборе только одностороннее. Таким образом, объём раствора во внутреннем сосуде увеличивается и поднимается по оттянутой горловине. В результате разницы в уровнях жидкостей во внешнем и внутреннем сосудах в приборе возникает гидростатическое давление. Это давление препятствует осмосу. Величина гидростатического давления, при которой осмос прекращается, называется осмотическим давлением раствора. (Росмотическое, кПа) Определение осмотического давления растворов производится следующим образом. Во внешний сосуд наливается чистая вода, стенки внутреннего сосуда представляют собой полупроницаемую мембрану. Внутренний сосуд снабжен оттянутой горловиной и мерительной линейкой. Во внутреннем сосуде находится какой - либо раствор, например, сахара. В силу осмоса молекулы воды из внешнего сосуда через полупроницаемые стенки будут проходить во внутренний, движение молекул в этом приборе только одностороннее. Таким образом, объём раствора во внутреннем сосуде увеличивается и поднимается по оттянутой горловине. В результате разницы в уровнях жидкостей во внешнем и внутреннем сосудах в приборе возникает гидростатическое давление. Это давление препятствует осмосу. Величина гидростатического давления, при которой осмос прекращается, называется осмотическим давлением раствора. (Росмотическое, кПа)
|
При постоянной температуре осмотическое давление раствора Р пропорционально его молярной концентрации
Р=1000СМ RT, Па
где С М – молярная концентрация, R- газовая постоянная (8,314 Дж/моль×К),Т – температура, К
Пример 2. При какой температуре замерзает водный раствор, полученный из 250г воды и 54 г глюкозы С6Н12О6?
Решение. При пересчете на 1000г воды, содержание глюкозы в растворе равно 216 г. Так как мольная масса глюкозы составляет 180 г/моль, то моляльность раствора равна Сm=216/180=1,20 моль/кг (Н2О).
По формуле (6.2) находим:
D tкрист =К× Сm =1,86×1,20=2,23°С.
Т.к. чистая вода кристаллизуется при 0°С, то раствор будет кристаллизоваться при tкр р-ра= t кр.р-ля- D t крист=00С-2,23=-2,230С
Ответ: tкрист = - 2,23°С.
3.Особенности применения законов Рауля и Вант-Гоффа для растворов электролитов. Теория С. Аррениуса. Электролиты – вещества, которые в воде диссоциируют на ионы.
Существует три класса электролитов: кислоты, гидроксиды, соли. Растворы электролитов имеют две особенности по сравнению с растворами неэлектролитов: проводят электроток, подчиняются законам Рауля и Вант - Гоффа с определёнными отклонениями. Обе особенности растворов электролитов объяснила гипотеза шведского учёного Сванте Аррениуса (1883 г). Гипотеза Аррениуса сводилась к тому, что вещества неидеальных растворов, то - есть то, что сейчас называется растворами электролитов, в воде диссоциируют на ионы. Поскольку неидеальные растворы проводили электроток, то их называли растворами электролитов. Для растворов электролитов в математические выражения законов Рауля и Вант - Гоффа был введён поправочный коэффициент. Ввёл его Вант – Гофф и назвал его изотоническим коэффициентом. i - поправочный коэффициент (изотонический коэффициент).
| Раствор неэлектролита | Раствор электролита | |
| CB = 1 моль / л | CB = 1 моль / л | |
| С12H22O11 | NaСl= Na++Cl- | |
| Сахар в воде диссоциирует | Соль в воде диссоциирует | |
| на молекулы | на ионы | |
| 1 моль молекул | 1 моль Na+ 1 моль Cl- | |
| Частиц будет больше | ||
| в 2 раза | ||
| Al(NO3)3=Al3++3NO-3 | ||
| Al(NO3) = Al3+ + 3NO-3 | ||
| (в 4 раза больше) | ||
| 1) 1< i <2 | ||
| 2) 1< i <4 |
Законы Рауля для растворов электролитов:
ΔP / Р А = i N B,
D Тф.п. = i К× Сm
Закон Вант – Гоффа для растворов электролитов:
Росмотическое = i RTCB
Физический смысл изотонического коэффициента состоит в том, что он учитывает увеличение количества частиц в растворе электролита по сравнению с раствором неэлектролита той же концентрации.
пример найти изотонический коэффициент для раствора электролита с концентрацией растворенного вещества 0,2М, если известно, что в 1 дм3 этого раствора содержится 2,18·1023 частиц (молекул и ионов) растворенного вещества.
Решение: i=Nфакт/Nрасч., где Nфакт- количество частиц(молекул и ионов) растворенного вещества, присутствующих в растворе; Nрасч - количество молекул растворенного вещества. i=Nфакт/ NА· СМ = 2,18·1023/(6,02·1023·0,2) =,
10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
1. концентрации растворов
2. криоскопии и эбулиоскопии..
3. изотонического коэффициента.
Задания
1.Какова процентная концентрация раствора, если в 200 г воды растворено 50 г вещества?
а) 25% б) 50% в) 20% г) 40%
2.Раствор, какого вещества замерзает при более низкой температуре?
i. а) глицерина б) NaCI в) СН3СООН г) CaCI2
Ответы:
1.Степень диссоциации электролитов. Все электролиты диссоциируют на ионы, но в количественном отношении диссоциируют по - разному.
Количественной характеристикой диссоциации электролитов является степень диссоциации. Степень диссоциации: λ= n/N (доли ед.), где n - количество молекул данного электролита, которые продиссоциировали на ионы; N - общее количество молекул данного электролита в растворе.
Если степень диссоциации превышает 30%, электролит относится к сильным,если  , то данный электролит является слабым.
, то данный электролит является слабым.
2. Механизм диссоциации И.А. Каблуков объяснил механизм диссоциации электролитов в воде на ионы. Электролиты диссоциируют на ионы в воде по двум механизмам:Ион - дипольный механизм; Диполь - дипольный механизм.
По ион - дипольному механизму диссоциируют на ионы те электролиты, которые имеют ионное строение. Когда электролит, имеющий ионную решетку, попадает в воду, то краевые ионы решетки начинают притягивать к себе молекулы воды и гидратируются ими. Под влиянием всевозможных видов движения гидратированные ионы отрываются от решетки и уходят в раствор. Процесс продолжается до полной диссоциации кристалла на ионы.Ион - дипольный механизм относится к диссоциации сильных электролитов.
Диполь- дипольный механизм: И электролит, и вода являются диполями. Два диполя притягиваются друг к другу, взаимно усиливая диполи. Оба полюса молекулы электролита оказываются гидратированными молекулами воды. Затем происходит полный разрыв молекулы электролита. В конечном итоге картина та же самая: гидратированные ионы уходят в раствор..
3.Диссоциация слабых электролитов. Суть диссоциации слабых электролитов в том, что они диссоциируют на ионы не полностью, обратимо.
Диссоциация слабых электролитов: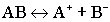 .Диссоциация слабых электролитов имеет две количественные характеристики:
.Диссоциация слабых электролитов имеет две количественные характеристики:
1) λ - степень диссоциации. Степень диссоциации не является константой, она зависит от двух факторов: от температуры (прямая зависимость); от концентрации раствора (обратная зависимость).
2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции. Кр=КД=[A+]р*[B+]р/[AB]р. Константа диссоциации изменяется с температурой, причём зависимость прямая. От концентрации растворов константа диссоциации не зависит.
Взаимосвязь между степенью и константой диссоциации установил немецкий химик Оствальд. 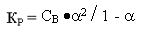 .Для слабых электролитов степень диссоциации много меньше единицы и поэтому в знаменателе формулы закона Оствальда ею пренебрегают.
.Для слабых электролитов степень диссоциации много меньше единицы и поэтому в знаменателе формулы закона Оствальда ею пренебрегают.
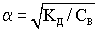 - закон разбавления Оствальда.
- закон разбавления Оствальда.
Многие слабые электролиты диссоциируют ступенчато. Каждая ступень имеет свою константу диссоциации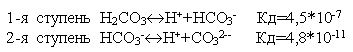 .
.
По первой ступени диссоциация заметна при нормальных условиях (при комнатной температуре). Диссоциация по второй ступени заметна при повышенной температуре, особенно при температуре кипения. Всегда Кд1>Кд2>Кд3
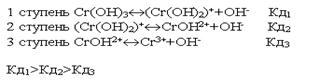
4.Ионное произведение воды. Водородный показатель Вода - самый слабый из существующих электролитов. Из 107 молекул воды диссоциирует на ионы только 1 молекула.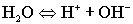 .Напишем выражение для константы диссоциации воды .Напишем выражение для константы диссоциации воды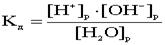 ..Принимая равновесную концентрацию воды константой, получаем: ..Принимая равновесную концентрацию воды константой, получаем:
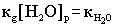 - ионное произведение воды (новая константа). Отсюда получаем: - ионное произведение воды (новая константа). Отсюда получаем:
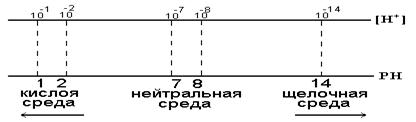
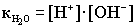 .При комнатной температуре .При комнатной температуре 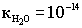 . В воде, т.е. в нейтральной среде, концентрация ионов водорода равна концентрации ионов гидроксида и равна 10-7 моль/дм3. Физический смысл ионного произведения воды заключается в том, что оно справедливо не только для чистой воды, но и для растворов кислот, гидроксидов, солей. . В воде, т.е. в нейтральной среде, концентрация ионов водорода равна концентрации ионов гидроксида и равна 10-7 моль/дм3. Физический смысл ионного произведения воды заключается в том, что оно справедливо не только для чистой воды, но и для растворов кислот, гидроксидов, солей. 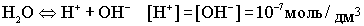 - нейтрльная среда
В H2O ввели кислоту, то есть Н+ [H+]>[OH- ] - нейтрльная среда
В H2O ввели кислоту, то есть Н+ [H+]>[OH- ] 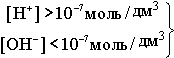 - кислая среда - кислая среда 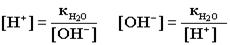 Если добавить к воде гидроксид, т.е. OH-, то [H+]<[OH- ].
Если добавить к воде гидроксид, т.е. OH-, то [H+]<[OH- ]. 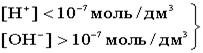 - щелочная среда. Чтобы избавится от отрицательной степени, для характеристики среды введено понятие водородныйпоказатель рH.рH = -lg[H+] - щелочная среда. Чтобы избавится от отрицательной степени, для характеристики среды введено понятие водородныйпоказатель рH.рH = -lg[H+]
Характер среды, то есть рH среды, определяют различными методами.Самое точное определение с помощью рH - метра. Наиболее простые методы измерения РН с помощью индикаторов. У жидких индикаторов есть свои интервалы измерения РН. Наиболее универсальным из индикаторов является лакмус. |
5.Диссоциация сильных электролитов. Диссоциация сильных электролитов настолько отличается от слабых, что была объяснена только через 40 лет после опубликования гипотезы Аррениуса. Суть диссоциации сильных электролитов заключается в том, что они диссоциируют полностью, необратимо: AB = A+ + B-. Истинная степень диссоциации сильных электролитов равна всегда 100 % (1,0 доли ед.).В растворах сильных электролитов ионов очень много (особенно при повышенных концентрациях). Отсюда две особенности растворов сильных электролитов: расстояния между ионами очень малы, иногда всего в 2-3 раза больше, чем в кристаллической решетке; количество ионов электролита соизмеримо с количеством молекул воды, и поэтому не все ионы могут быть гидратированы молекулами воды. В силу этих двух особенностей каждый ион в растворе сильного электролита окружён ионами противоположного заряда, так называемой, " ионной атмосферой ". В растворах сильных электролитов ионы мешают друг другу принимать участие в физических и химических процессах. Кажущаяся степень диссоциации (αкаж.) отражает то количество активных ионов, которые принимают участие в химических и физических процессах. Поэтому αкаж. всегда меньше 100 % (1,0). Истинная степень диссоциации сильных электролитов всегда равна 1,0, кажущаяся степень диссоциации возрастает с повышением температуры раствора и понижением концентрации раствора. Кажущаяся степень диссоциации связана с изотоническим коэффициентом соотношением: αкаж. = i-1 / n-1, где n - количество ионов, на которые диссоциирует данный электролит. Под активностью понимается та часть ионов, которая приняла участие в физических и химических процессах, активность всегда меньше концентрации. Поэтому αкаж< αист.Активность и концентрация связаны между собой коэффициентом активности γ: a = γ .c. Коэффициент активности - отношение экспериментальной величины к теоретической: γ = экспериментальная величина/теоретическая величина. В случае разбавленных растворов (для CB< 0,1М) коэффициент активности близок к единице, поэтому для разбавленных растворов сильных электролитов можно пользоваться понятием концентрации.
6.Условия необратимого протекания реакций между электролитами Все электролиты диссоциируют на ионы, поэтому суть реакции между электролитами выражают кратким ионным уравнением. Для того, чтобы реакция между электролитами протекала необратимо, необходимо, чтобы часть ионов оказалась связанной или в легко летучее соединение, или в трудно растворимый осадок, или в слабый электролит.
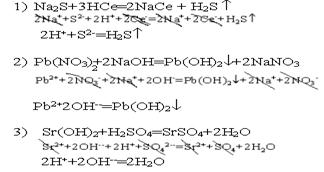
|
Любой раствор может быть насыщенным, ненасыщенным и перенасыщенным. Ненасыщенным называют раствор, в котором при данной температуре можно растворить ещё какое - то количество данного вещества.Н асыщенным называют раствор, в котором скорость реакции растворения равна скорости реакции осаждения. Концентрация насыщенного раствора для данного вещества при данной температуре есть величина постоянная, следовательно в насыщенном растворе концентрации ионов данного электролита являются константами. Перенасыщенными называют растворы, которые содержат осадок. Насыщенные растворы трудно растворимых электролитов характеризуется величиной, называемой произведением растворимости. AB - трудно растворимый электролит:
AB=A++B-
ПРАВ = [A+]*[B-] - насыщенный раствор,
ПРАВ > [A+]*[B-] - ненасыщенный раствор,
ПРАВ < [Ag+]*[B-] - перенасыщенный раствор.
Be(OH)3  Bi3++3OH-
Bi3++3OH-
ПРBi(OH)3 = [Bi3+]*[OH--]3. Добавление в раствор одноимённых ионов труднорастворимого электролита способствует выпадению в осадок иона противоположного знака.
8. Гидролиз солей. Гидролизом называется взаимодействие солей и воды, с образованием слабодиссоциирующих веществ, одновременно сопровождающееся смещением ионного равновесия воды. Отсюда следует, что не всякое взаимодействие соли с водой является гидролизом, а следовательно, не все соли гидролизу подвергаются. Гидролизу подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (Na2CO3,CH3COOK), катионом слабого основания и анионом сильной кислоты (ZnCl2, Al2(SO4)3, катионом слабого основания и анионом слабой кислоты (CH3COONH4, Al2S3). Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.При анализе состава солей нужно помнить, что:
| 1. К сильным основаниям относятся: LiOH, KOH, NaOH, CsOH, RbOH, Ca(OH)2, Ba (OH)2, Sr(OH)2, Rа(OH)2. 2.К сильным кислотам относятся: H2SO4, H2SеO4, HNO3, HClO4, HBr, HI, HCl. | 3. Слабые основания образуют катионы всех остальных металлов и NH4+. 4. К слабым кислотам относятся: H2SO3, HNO2, HClO, HF, H3PO3, H2CO3, H2S, H2SiO3 ,CH3COOH и др. |
Соли, образованные многокислотными основаниями, или многоосновными кислотами, подвергаются ступенчатому гидролизу. Более легко протекает первая ступень гидролиза, и на ней, как правило, при обычных условиях гидролиз солей завершается. Скорость гидролиза зависит от растворимости солей, оснований и кислот, поэтому необходимо учитывать этот фактор Гидролизу подвергается не все количество находящейся в растворе соли, а только часть ее. Иначе говоря, в растворе устанавливается равновесие между солью и образующими ее кислотой и основанием. Доля вещества, подвергающаяся гидролизу, - степень гидролиза, - зависит от константы этого равновесия, а также от температуры и концентрации соли.
Запишем уравнение гидролиза в общем виде. Пусть НА- кислота, МОН- основание, МА – образованная ими соль. Тогда уравнение гидролиза будет иметь вид:
МА + Н2О ↔НА + МОН
Этому равновесию отвечает константа:
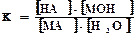
Концентрация воды в разбавленных растворах представляет собой практически постоянную величину. Обозначая К·[ Н2О] =Кг, получим:
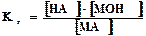 . Величина Кг называется константой гидролиза соли. Ее значение характеризует способность данной соли подвергаться гидролизу; чем больше Кг, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз. Для соли, образованной катионом сильного основания и анионом слабой кислоты, константа гидролиза связана с константой диссоциации кислоты Ккисл зависимостью:
. Величина Кг называется константой гидролиза соли. Ее значение характеризует способность данной соли подвергаться гидролизу; чем больше Кг, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз. Для соли, образованной катионом сильного основания и анионом слабой кислоты, константа гидролиза связана с константой диссоциации кислоты Ккисл зависимостью:


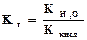 . Это уравнение показывает, что Кг тем больше, чем меньше Ккисл. Иными словами, чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли. Для солей, образованных катионом слабого основания и анионом сильной кислоты, аналогичное выражение связывает константу гидролиза с константой диссоциации основания Косн
. Это уравнение показывает, что Кг тем больше, чем меньше Ккисл. Иными словами, чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли. Для солей, образованных катионом слабого основания и анионом сильной кислоты, аналогичное выражение связывает константу гидролиза с константой диссоциации основания Косн
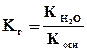 . Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли. Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость степени гидролиза (h) от концентрации выражается через закон разбавления:
. Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли. Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость степени гидролиза (h) от концентрации выражается через закон разбавления:
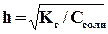 ,то есть с разбавлением раствора степень гидролиза увеличивается.
,то есть с разбавлением раствора степень гидролиза увеличивается.
Влияние температуры на степень гидролиза вытекает из принципа Ле-Шателье. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз с поглощением теплоты. Поскольку выход эндотермических реакций с ростом температуры увеличивается, то и степень гидролиза растет с повышением температуры.
Пример 1. Составить молекулярное и ионное уравнение гидролиза соликарбоната натрия.
Решение. Соль Na2СO3 образована сильным основанием (NaOH) и слабой кислотой (H2СO3 ), таким образом, г идролиз соли будет протекать по аниону. Так как ион СO32- содержит 2 заряда, то гидролиз возможен в 2 ступени: первая ступень протекает в обычных условиях, вторая – при нагревании или разбавлении. Рассмотрим гидролиз по первой ступени:
Сокращенное ионное уравнение гидролиза:
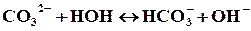
полное ионное уравнение гидролиза:
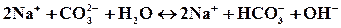
молекулярное уравнение:
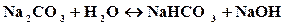
Так как в растворе накапливаются гидроксид-ионы, то среда щелочная, т.е. рН>7.
9. Диссоциация комплексных соединений.
В водных растворах комплексные соли диссоциируют в две стадии. Внешнесферная диссоциация комплексных солей происходит практически полностью с образованием комплекных ионов и ионов внешней сферы. Эта диссоциация называется первичной. Комплексные ионы, в свою очередь, под воздействием дополнительных внешних факторов, подвергаются вторичной диссоциации на центральный ион и лиганды. Вторичная диссоциация протекает незначительно и характеризуется константой равновесия, называемой константой нестойкости комплексного иона. Чем устойчивее комплексный ион, тем меньше его константа нестойкости.
Пример 2. Написать уравнения первичной и вторичной диссоциации комплексной соли [Ag(NH3)2]Cl. Составить выражение для константы нестойкости комплексного иона.
Решение. Первичная диссоциация протекает согласно уравнению:
[Ag(NH3)2 ] Cl→ [Ag(NH3)2]+ + Cl-
Комплексный ион, в свою очередь, подвергается вторичной диссоциации на центральный ион и лиганды:
[Ag(NH3)2]+↔ Ag+ +2 NH3; составим выражение для константы нестойкости комплексного иона:
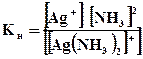
11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
1. Ионные реакции в растворах..
2. Водородный показатель.
3. Гидролиз солей
4. Произведение растворимости.
5. Диссоциация комплексных соединений.
Задания
1, В какой смеси веществ возможна химическая реакция?
а) Bi(OH)3 + NaOH ↔ б) Bi(OH)3 + HCI
в) Bi2S3 + H2O↔ г) Bi2S3 + HCI ↔
разб.
2. pH=12, [H+]=?
а) 10-7 моль/л б) 10-12 моль/л в) 10-2 моль/л г) 10-6 моль/л
3. Какие вещества нужно добавить к раствору AI2(SO4)3 для смещения равновесия реакции гидролиза вправо?
a) Na2SO4,б) NaCI в) HNO3 г) Н2О
4. ПРAgCI=1,21·10-10. Рассчитать молярную растворимость:
а) 1,21·10-10моль/л б) 1,1·10-5моль/л в) 2·10-5 моль/л
г) 1,2·10-3 моль/л
5. Какой заряд имеет ион [Fe2+(NC)5OH2]?
а) 3- б) -2 в) 3+ г) +2
Ответы:
Лекция 12. Дисперсные системы и поверхностные явления.
Дисперсность и дисперсные системы. Поверхностные явления. Коллоидные системы. Классификация коллоидных систем. Получение коллоидных растворов. Золи и гели. Мицеллы и их строение. Устойчивость коллоидных систем. Оптические и электрические свойства.
12.1 Дисперсность и дисперсные системы. Слово дисперсия означает раздробление, измельчение. Дисперсные системы состоят как минимум из двух компонентов: дисперсионной среды, которая играет роль растворителя и, следовательно, является непрерывной фазой; дисперсной фазы, играющей роль растворённого вещества.
Существуют два типа классификаций дисперсных систем.
Первый тип классификации основан на агрегатном состоянии дисперсионной среды и дисперсной фазы, табл.1.
Таблица 1
| Дисперсионная среда | Дисперсная фаза | Тип системы | Примеры |
| Жидкая | Твёрдая | Золи,суспензии | Известковые, цементные растворы |
| Жидкая | Эмульсия | Молоко, масло, сметана, керосин в воде | |
| Газообразная | Пены | Мыльная пена, морской прибой | |
| Твёрдая | Твёрдая | Твёрдые коллоиды | Металлические сплавы |
| Жидкая | Пористые тела, насыщенные влагой | Влажный грунт, опал, жемчуг | |
| Газообразная | Твёрдые пены | Газобетон, полистирол, пемза | |
| Газообразная | Твёрдая | Пыль, дым | Угольная пыль |
| Жидкая | Туман | Облака и тучи | |
| Газообразная | Смесь газов | Атмосфера земли |
Второй тип классификации основан на размерах частиц дисперсной фазы,табл.2.
Таблица 2
| Размер частиц дисперсной фазы | 10-5 - 10-7 м | 10-7 - 10-4м | <10-9м |
| Название системы | Грубо - дисперсная | Коллоидно – дисперсная | Молекулярно - дисперсная |
| Характеристика системы | Микрогетерогенная (по той причине, что границу раздела фаз можно увидеть только с помощью микроскопа) | Гомогенная |
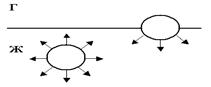 12.2 Поверхностные явления. Рассмотрим молекулу, (рис.), находящуюся в глубине своей фазы. Такая молекула взаимодействует со всеми окружающими её молекулами, и все её энергетические связи насыщены. У молекулы, расположенной на границе раздела фаз, насыщены только те связи, которые направлены вглубь ее фазы. Такая молекула обладает избыточной потенциальной энергией. Свободная поверхность жидкости или твёрдого тела обладает избытком поверхностной энергии. Как любая система, дисперсные системы стремятся понизить избыточную энергию, что возможно путем уменьшения площади поверхности раздела фаз, т.е. укрупнения частиц. Слияние частиц дисперсной фазы и их укрупнение называется коагуляцией. Укрупнённые частицы под действием собственной тяжести начинают выпадать в осадок. Этот процесс медленный и носит название седиментации. В результате образуется истинный раствор, содержащий осадок. Дисперсная система перестаёт существовать. Данный путь понижения поверхностной энергии ведёт к разрушению дисперсной системы.
12.2 Поверхностные явления. Рассмотрим молекулу, (рис.), находящуюся в глубине своей фазы. Такая молекула взаимодействует со всеми окружающими её молекулами, и все её энергетические связи насыщены. У молекулы, расположенной на границе раздела фаз, насыщены только те связи, которые направлены вглубь ее фазы. Такая молекула обладает избыточной потенциальной энергией. Свободная поверхность жидкости или твёрдого тела обладает избытком поверхностной энергии. Как любая система, дисперсные системы стремятся понизить избыточную энергию, что возможно путем уменьшения площади поверхности раздела фаз, т.е. укрупнения частиц. Слияние частиц дисперсной фазы и их укрупнение называется коагуляцией. Укрупнённые частицы под действием собственной тяжести начинают выпадать в осадок. Этот процесс медленный и носит название седиментации. В результате образуется истинный раствор, содержащий осадок. Дисперсная система перестаёт существовать. Данный путь понижения поверхностной энергии ведёт к разрушению дисперсной системы.
Второй путь понижения поверхностной энергии - сорбция. Сорбция - это поглощение одного вещества другим. Поглотитель - сорбент, поглощаемое вещество - сорбат. Если поглощение происходит только в поверхностном слое сорбента, т.е. происходит поверхностная сорбция, она называется адсорбцией. Если же сорбат продиффундировал по всему объёму сорбента, т.е. если произошла объёмная сорбция, она называется абсорбцией. По механизму протекания процесса сорбция подразделяется на: физическую, химическую. При физической сорбции между сорбентом и сорбатом происходит только межмолекулярное взаимодействие, т.е. сцепление достаточно непрочное, и со временем начинается обратный процесс - процесс отдачи поглощённого вещества, и в конце концов устанавливается равенство скоростей обоих процессов: Vадсорбции == Vдесорбции. При химической сорбции (хемосорбции) между сорбентом и сорбатом возникает химическое взаимодействие, в результате чего между ними образуется третье вещество, рис.2.
 Химическая сорбция намного прочнее физической, десорбция самопроизвольно практически не происходит. Ещё одно отличие между физической и химической сорбцией заключается в том, что при повышении температуры физическая сорбция уменьшается, а химическая увеличивается. В чистом виде физическая и химическая сорбция встречаются редко, чаще всего сорбция включает элементы их обеих.
Химическая сорбция намного прочнее физической, десорбция самопроизвольно практически не происходит. Ещё одно отличие между физической и химической сорбцией заключается в том, что при повышении температуры физическая сорбция уменьшается, а химическая увеличивается. В чистом виде физическая и химическая сорбция встречаются редко, чаще всего сорбция включает элементы их обеих.
Вещества, понижающие поверхностное натяжение, называются поверхностно-активными (ПАВ). К ПАВ относятся органические вещества, молекулы которых состоят из участков с резко различными свойствами. Одна часть молекул – полярная группа, другая – неполярная часть, состоящая из углеводородного радикала. К полярным группам относятся –ОН, -СООН, -NН2, -SО2Н и др. ПАВ. Молекулы ПАВ’а менее полярны, чем молекулы воды. Благодаря этому взаимодействие молекул воды между собой сильнее, чем молекул воды с молекулами ПАВ’а. В результате молекулы ПАВ’а будут вытесняться из раствора в поверхностный слой. Повышение концентрации третьего вещества в поверхностном слое, в частности, молекул ПАВ’а, приводит к понижению поверхностного натяжения.
3.Классификация коллоидных систем. Коллоидное сотояние характерно для многих веществ, если их частицы имеют размер от 1 до 500 нм. Суммарная поверхность этих частиц огромна. Характерной особенностью коллоидных частиц является наличие на их поверхности заряда. обусловленного избирательной адсорбцией ионов.. Существуют лиофильные (гидрофильные коллоиды, в которых растворитель взаимодействует с ядрами частиц, и лиофобные (гидрофобные) коллоиды, в которых растворитель не взаимодействует с ядрами частиц. Золями называют такие коллоидно - дисперсные системы, в которых дисперсионной средой (т.е. растворителем) является вода. Золи подразделяются на: гидрофильные; гидрофобные. Гидрофильные золи образуются такими веществами, как крахмал, желатин, яичный желток и белок и многие краски. Приготовление гидрофильных золей не требует специальных методов. В гидрофильных золях вода играет двоякую роль: она является одновременно растворителем и стабилизатором. Молекулы воды, гидратируя частицы дисперсной фазы, не позволяют им подходить друг к другу и слипаться, т.е. они препятствуют процессу коагуляции. В этом заключается стабилизирующая роль воды.
Гидрофобные золи образуются такими веществами, как трудно растворимые гидроксиды и соли, металлы, а также многие органические вещества.
4. Получение коллоидных растворов. Методы подразделяются на физические и химические. И физические, и химические методы подразделяются на: дисперсионные, т.е. разукрупняющие; конденсационные, т.е. укрупняющие. Физическая конденсация может осуществляться из паров или путем замены растворителя. Конденсация из паров основана на одновременной конденсации паров диспергируемого вещества и растворителя на холодной поверхности. Таким образом получают гидрозоли металлов. Метод замены растворителя основан на изменении состава и свойств дисперсионной среды и заключается в том, что истинный раствор вещества добавляется к жидкости, смешивающейся с растворителем, но в которой само вещество мало растворимо и выделяется в виде высокодисперсной фазы. Химические методы получения гидрофобных золей основываются на реакциях: обмена; гидролиза; окисления – восстановления.
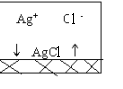
5.Мицеллы и их строение. Строение коллоидной частицы рассмотрим на примере образования коллоидной частицы AgCl, происходящего в результате реакции
AgNO3 + KCl = AgCl↓ + КNO3
Молекулы AgCl объединяются в практически нерастворимые дисперсные частицы, в которых ионы Ag+ и Cl- образуют кристаллическую решетку.Если AgNO3 и KCl взяты в эквивалентных количествах, то частицы-кристаллики растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок.
Если одно из исходных веществ (например, AgNO3) взято в небольшом избытке, то оно служит стабилизатором, сообщающим устойчивость коллоидным частицам. Построение кристаллической решетки AgCl может идти только за счет ионов, входящих в ее состав; в данном случае за счет ионов Ag+. Ионы Ag+ будут продолжать достраивать кристаллическую решетку ядра, прочно входя в его структуру и сообщая ему электрический заряд. В связи с этим ионы, достроившие кристаллическую решетку ядра, называются потенциалопределяющими ионами. Величина электрического заряда у многих коллоидных частиц достигает 1 в. Частицы с таким относительно высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные (называемые поэтому противоионами) ионы NO3-. Начнется процесс адсорбции противоионов, в результате которого установится динамическое равновесие между адсорбированными и свободными ионами. Основная часть всех противоионов, адсорбированная на ядре коллоидной частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой. Ядро и адсорбционный слой вместе составляют гранулу. Остаток противоионов удерживается электростатическими силами притяжения вблизи гранулы, образуя диффузный слой. Таким образом, на коллоидной частице возникает двойной электрический слой (ДЭС), состоящий из ионов на поверхности (потенциалопределяющих ионов) и из компенсирующих заряд поверхности ионов (противоионов) в растворе; причем часть противоионов находится в прилегающем к поверхности и прочно связанном с ней адсорбционном слое, а другая часть – в диффузном слое, удаленном от поверхности. Частица дисперсной фазы вместе с диффузным слоем образует электронейтральную мицеллу.
Строение мицеллы золя AgCl, стабилизированного AgNO3, можно представить в виде формулы:
{n[AgCl]mAg+(m-x)NO3-}х+· х NO3-,
где n – число молекул, образующих дисперсную частицу; m – число потенциалопределяющих ионов; (m-x) – число противоионов адсорбционного слоя; х – число противоионов диффузного слоя.
Если золь хлорида серебра стабилизирован хлоридом калия, то строение его мицеллы будет выглядеть следующим образом:
{n[AgCl]mCl-(m-x)К+}х-· х К+.
Оптические свойства золей. Золи отличаются от истинных растворов визуально, с помощью так называемого конуса Тиндаля. Если на плоскопараллельную кювету,заполненную истинным раствором, направить узкий луч видимого света, то будут видны точки входа и выхода луча. Ход луча в растворе не будет виден. В силу того, что частицы растворённого вещества несоизмеримо меньше длины волны луча, луч проходит через раствор,"не замечая" эти частицы, поэтому его ход и не виден. Если такой луч направить на кювету с золем, рис.9, то ход луча будет виден в виде светящегося конуса голубоватого цвета. Размер частиц дисперсной фазы меньше длины волны луча по меньшей мере в 10 раз. Но в данном случае луч "замечает" эти частицы и огибает их. Происходит явление дифракции, в результате чего и возникает этот конус.
Электрические свойства золей. Рассмотрим мицеллу золя в разрезе, рис.10.
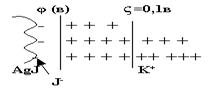 Рис.10
Рис.10
| На границе определяющих ионов и противоионов возникает потенциал φ, равный ≈ 1В.На границе гранулы и диффузионного слоя возникает ещё один потенциал ζ, так называемый дзета - потенциал, величина которого не превышает 0,1В. |
Если к раствору гидрофобного золя подвести постоянное напряжение, то мицелла разорвётся по ζ - потенциалу. Гранула мицеллы пойдёт к одному электроду, в соответствии со своим зарядом, а диффузионный силой, увлекая за собой прилежащие к нему слои воды, - к другому электроду.Перемещение гранулы к электроду называется электрофорезом. Перемещение диффузионного слоя с прилежащими слоями воды называется электроосмосом. Поскольку диффузный слой содержит мало вещества, то его отложение на электроде было обнаружено недавно, когда появились точные методы. Тем не менее ζ - потенциал очень важен для существования гидрофобных золей.
6.Устойчивость и разрушение коллоидных систем. В термодинамически неустойчивых коллоидных системах непрерывно протекают самопроизвольные процессы, ведущие к укрупнению частиц. Оно возможно двумя путями: 1) за счет перекристаллизации; 2) за счет слипания частиц в более крупные агрегаты (коагуляции или коалесценции). Перекристаллизация идет медленнее. Коагуляция протекает быстрее. Ее можно вызвать понижением температуры, кипячением, встряхиванием. Все электролиты способны коагулировать коллоидные системы в определенных концентрациях. Коагулирующим является ион, по знаку противоположный заряду частицы. Стабилизирующую роль играют заряды диффузионного слоя.
Разрушающее действие постороннего электролита заключается в том, что однозарядный ион вытесняет противоионы диффузионного слоя в адсорбционный слой.
уменьшается заряд диффузного слоя.
уменьшается заряд гранулы.
В конечном счёте уменьшается ζ - потенциал. С уменьшением ζ - потенциала мицеллы начинают терять свою защиту и слипаются. Когда слипание частиц достигает такого предела, что становится заметным помутнение раствора, соответствующая этому состоянию величина ζ - потенциала носит название – порог коагуляции.
Состояние, при котором ζ - потенциал становится равным нулю, называется изоэлектрическим состоянием. При изоэлектрическом состоянии коагуляция идёт полным ходом.
12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
1. Классификация коллоидных систем
2. устойчивость коллоидных систем.
3. поверхностные явления
Упражнения:
1.Дисперсной системой является: а)соляной раствор, б) молоко; в) сахар; г) минеральная вода
2.Согласно теории строения коллоидных растворов мицелла является: а)электронейтральной, б) отрицательно заряженной,; в) положительно заряженной; г) радикалом
3. Для золя AgI, полученного по реакции AgNO3(изб) + KI = AgI↓ + КNO3 коагуляцию вызывают: а)катионы, б) анионы; в) катионы +анионы; г) нейтральные частицы
4.При растворении в воде ПАВ величина поверхностного натяжения: а)уменьшается, б) не изменяется,; в) увеличивается; г) уменьшается, затем увеличивается.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2965; Нарушение авторских прав?; Мы поможем в написании вашей работы!