
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз водных растворов электролитов
|
|
|
|
Электролиз водных растворов электролитов более сложен, так как кроме ионов электролита на электродах могут претерпевать изменение молекул воды:
1. восстанавливаться на катоде по схеме
2Н2О + 2 ē ® Н2 + 2ОН–;
2. окисляться на аноде по схеме
2Н2О – 4 ē ® О2 + 4Н+.
Таким образом, при электролизе водных растворов электролитов на каждом из электродов принципиально возможно протекание двух или большего числа процессов. Из ряда конкурирующих процессов на электроде в первую очередь реализуется тот процесс, осуществление которого связано с меньшими затратами энергии. Это означает:
1. На катоде восстанавливаются в первую очередь окисленные формы систем с наибольшим значением окислительно-восстановительного потенциала;
2. На аноде в первую очередь окисляются восстановленные формы систем, которые имеют меньшее значение окислительно-восстановительного потенциала.
При реализации данных принципов на практике следует вычислить потенциалы всех возможных процессов и сравнить их между собой.
На катоде могут возникнуть три случая:
1. Потенциал восстановления катиона Е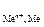 больше потенциала восстановления воды Е
больше потенциала восстановления воды Е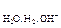 , причем абсолютная разность между потенциалами конкурирующих процессов ½D Е ½ превышает 0,1 В. В этом случае, на катоде восстанавливаются катионы металла
, причем абсолютная разность между потенциалами конкурирующих процессов ½D Е ½ превышает 0,1 В. В этом случае, на катоде восстанавливаются катионы металла
Mе n + + n×ē ® Me
2. Е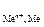 < Е
< Е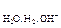 , причем
, причем 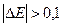 В, тогда на катоде идет процесс восстановления молекул воды.
В, тогда на катоде идет процесс восстановления молекул воды.
3. Е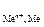 » Е
» Е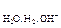 , то есть
, то есть 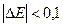 В, тогда на катоде идут сразу оба восстановительных процесса
В, тогда на катоде идут сразу оба восстановительных процесса
Mе n + + 2Н2О + (2 + n)× ē ® Me + Н2 + 2ОН–
Для процессов на аноде в первую очередь следует определить тип анода. Если анод растворимый, то тогда независимо от состава электролита будет происходить окисление материала анода. Например, для железного анода
Fe – 2 ē ® Fe2+
Если анод инертный, то окислению будет подвергаться одна из частиц электролита. В реальных процессах порядок разряда частиц на инертном электроде зависит не только от окислительно-восстановительного потенциала системы, но и от перенапряжения. А нодное перенапряжение при окислении молекул воды (кислородное перенапряжение), то есть сдвиг потенциала окисления Н2О в положительную сторону, связано с кинетическими затруднениями при образовании молекулы О2. В результате теоретически выделение кислорода должно начинаться при потенциале +0,815 В, а практически это происходит только при напряжении более +1,5 В.
При реализации процессов окисления на инертном аноде выполняются следующие правила:
1. В первую очередь на инертных анодах в разбавленных водных растворах окисляются простые анионы в порядке возрастания их стандартных потенциалов, не превышающих +1,5 В, то есть S2-, I–, Br–, Cl–. Вода при этом не окисляется.
2. При электролизе водных растворов, содержащих анионы кислородсодержащих кислот (СО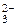 , NO
, NO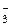 , SO
, SO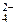 и др.), данные анионы не окисляются, вместо них на аноде окисляются молекулы воды по схеме
и др.), данные анионы не окисляются, вместо них на аноде окисляются молекулы воды по схеме
2Н2О – 4× ē ® О2 + 4Н+,
а в щелочных растворах ионы ОН– по схеме
4 ОН– – 4 ē ® О2 + 2Н2О.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1117; Нарушение авторских прав?; Мы поможем в написании вашей работы!