
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металлов
|
|
|
|
Коррозия – это самопроизвольное разрушение металлов или сплавов металлов в результате их физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии. Причиной коррозионных разрушений является термодинамическая неустойчивость материалов в естественных условиях, т.е. изменение энергии Гиббса процесса коррозии должно быть отрицательным (DG < 0).
По механизму протекания различают химическую и электрохимическую коррозию.
Химическая коррозия протекает в средах, не проводящих электрический ток, таких как сухие газы или растворы неэлектролитов. В результате химической коррозии металл покрывается слоем продуктов его окисления – чаще всего пленкой оксида или гидрооксида. Образующаяся пленка препятствует диффузии окислителя к чистому металлу и тем самым замедляет, а иногда и полностью прекращает дальнейшую коррозию металла.
Электрохимическая коррозия наблюдается в средах, способных проводить электрический ток – влажный воздух, вода, водные растворы солей, кислот и оснований, почва и др. Данный вид коррозии протекает по механизму действия гальванического элемента, в котором окислительный (анодный) и восстановительный (катодный) процессы разделены в пространстве.
Окисляющиеся участки металла (анодные участки) имеют меньшее значение потенциала, на них металл в виде ионов переходит в водную среду по реакции
Mе – nē ® Me n +
При этом на металле накапливается отрицательный заряд.
На катодных участках, то есть участках с более высоким значением потенциала, восстанавливаются частицы окислителя
Ox + n ē ® Red.
Так как окислитель принимает электроны, то есть снимает избыточный отрицательный заряд с поверхности металла (деполяризует его), то его называют деполяризатор.
Причинами энергетической неоднородности поверхности металла, которые приводят к образованию короткозамкнутых макро- или микрогальванических пар, являются:
1. Наличие контактов двух или более металлов, обладающих различными значениями потенциалов;
2. Наличие примесей в металле или продуктов его окисления на поверхности;
3. Внутренние напряжения в конструкции из металла и др.
Окислителями при электрохимической коррозии чаще всего служат молекулы кислорода, растворенного в воде или ионы Н+. При этом на катодных участках могут происходить процессы:
1. В нейтральной или щелочной среде
О2 + 2Н2О + 4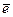 ® 4ОН– (коррозия с кислородной деполяризацией)
® 4ОН– (коррозия с кислородной деполяризацией)
2. В кислой среде
О2 + 4Н+ + 4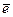 ® 2Н2О (коррозия с кислородной деполяризацией)
® 2Н2О (коррозия с кислородной деполяризацией)
или 2Н+ + 2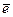 ® Н2 (коррозия с водородной деполяризацией)
® Н2 (коррозия с водородной деполяризацией)
Возможность протекания коррозии того или иного металла следует определять следующим образом: сравнить потенциал металла (восстановителя) с потенциалом окислителя. Если Е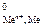 < Е
< Е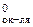 , то металл может подвергаться коррозии.
, то металл может подвергаться коррозии.
При оценочных расчетах можно считать, что потенциал процесса с кислородной деполяризацией равен +0,815 В, а потенциал процесса с водородной деполяризацией можно оценивать при помощи уравнений (5) или (6).
Основными способами защиты металлов от коррозии являются легирование металлов, нанесение защитных покрытий, методы электрохимической защиты, применение замедлителей (ингибиторов) коррозии и приемы рационального конструирования изделий из металлов.
Одним из самых доступных и чаще всего применяемых методов защиты является нанесение на металлы покрытий, которые бывают металлическими и неметаллическими.
Материалами для металлических покрытий могут служить как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром и др.), так и их сплавы (бронза, латунь и др.).
По характеру поведения металлических покрытий при коррозии их делят на катодные и анодные. К катодным покрытиям относят покрытия, выполненные из металлов, имеющих большее значение потенциала, чем у основного (защищаемого) металла. При повреждении такого покрытия возникает макрогальванический элемент, в котором защищаемый металл становится анодом и растворяется, а металл покрытия – катодом, на котором восстанавливаются частицы окислителя. Таким образом, катодные покрытия являются защитными, только пока они не повреждены. Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. В случае повреждения анодного покрытия его защитное действие не прекращается, так как в созданном гальваническом элементе основной металл – катод, то есть не окисляется, а металл покрытия – анод.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 395; Нарушение авторских прав?; Мы поможем в написании вашей работы!