
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изотонические растворы
|
|
|
|
Растворы осмотическое давление которых равно осмотическому давлению жидкости организма. Осмотическое давление регулируется осморегуляторами (7,4 атм).
Если вводится в кровь большое количество гипертонического раствора – происходит плазмолиз. При введении гипотонического раствора – гемолиз.
Существуют различные методы расчета изотонической концентрации.
1. закон Вант-Гоффа
2. закон Рауля
3. использование изотонического эквивалента лекарственного веществ по натрия хлориду. ЕЛ.в/NaCl.
I Используется уравнения Менделеева-Клапейрона, рассчитано, чтобы приготовить изотонический раствор любого неэлектролита нужно взять 0,29 моль/л этого вещества.
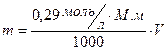
М.м. глюкозы = 180,18
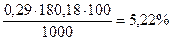
для натрия хлорида – 0,9%.
Для электролитов используют изотонический коэффициент i, который показывает во сколько раз увеличивается число частиц при диссоциации электролитов.
NaCl, KCl, KNO3 i = 1,86
ZnSO4, MgSO4 i = 1,5
Na2SO4, CaCl2 i = 2,5
Слабые электрол. i = 1,1
Это расчет для неэлектролитов.
II. Более точный. Устанавливается зависимость между концентрацией раствора и температурой замерзания раствора.
Понижение температуры замерзания называется депрессией. Депрессия жидкости организма постоянна и равна -0,520. Если приготовить раствор лекарственного вещества с депрессией 0,52, то он будет изотоническим. Определили депрессию 1% растворов Dt.
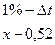
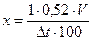
Dt глюкозы = 0,1
III. Изотонический эквивалент – количество натрия хлорида, которое создает в тех же условиях осмотическое давление, что и осмотическое давление 1,0 лекарственного вещества.
Изотоническая концентрация натрия хлорида – 0,9%. ЭГл/NaCl = 0,18
Лекция № 21
 |
|
0,9 NaCl - х глюкозы
х = 5,0 глюкозы безводной.
Расчет концентрации в двухкомпонентных смесях.
Recipe: Sol. Novocaini 1% - 100 ml
Natrii chloridi q.s., ut fiat solutionis isotonicae
D.S.
Энов/NaCl = 0,18
0,18 натрия хлорида - 1,0 новокаина
1,0 г. новокаина
0,9 г. натрия хлорида – 0,18 = 0,72 г. натрия хлорида.
Технология:
Стабилизатор - 9 мл/л 0,1М раствора соляной кислоты. Остальное аналогично предыдущему рецепту.
Recipe: Sol. Novocaini 1% - 100 ml
Glucosi q.s., ut fiat sol. Isotonicae
D.S.
Расчеты:
Рассчитываем натрия хлорид.
0,72г. натрия хлорида (схема расчета см. выше).
Эглюкозы/NaCl = 0,18
0,18 NaCl - 1,0 глюкозы безводной
0,72 NaСl - х глюкозы
х = 4,0 глюкозы б/в или 4,44 глюкозы водной.
Стабилизируем раствором соляной кислоты.
Recipe: Atropini sulfatis 1% - 100 ml
Natrii chloridi q.s., ut fiat sol. Isotonicae.
D.S.
Эатр/NaCl = 0,1
0,1 NaCl - 1 атропина
х - 0,1 атропина
х = 0,01 атропина сульфата.
0,09 натрия хлорида на 10 мл.
0,09 – 0,01 = 0,08 натрия хлорида.
Стабилизируем 10 мл/л 0,1М соляной кислотой.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1017; Нарушение авторских прав?; Мы поможем в написании вашей работы!