
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамический и статистический методы
|
|
|
|
Лекция 1
СТАТИСТИЧЕСКАЯ ФИЗИКА И ТЕРМОДИНАМИКА
1. Молекулярно – кинетическая теория
Молекулярная физика изучает строение и свойства вещества исходя из молекулярно-кинетических представлений - любое тело состоит из большого числа хаотически движущихся молекул, которые не имеют преимущественного направления. Интенсивность этого движения зависит от температуры вещества.
Доказательством хаотического движения молекул является броуновское движение.
Молекулярно - кинетическая теория объясняет свойства тел, которые наблюдаются на опыте. Она использует статистический метод, рассматривая не движение отдельных молекул, а лишь средние величины, характеризующие движение всей совокупности частиц. Отсюда и другое ее название – статистическая физика.
Всякий материальный объект, всякое тело, состоящее из большого числа частиц, называется макроскопической системой. Размеры макроскопических систем значительно больше размеров атомов и молекул. Все макроскопические признаки, характеризующие такую систему и ее отношение к окружающим телам, называются макроскопическими параметрами. К их числу относятся плотность, объем, упругость, концентрация, поляризованность, намагниченность и т.д. Макроскопические параметры разделяются на внешние и внутренние.
Величины, определяемые положением не входящих в нашу систему внешних
тел, называются внешними параметрами, например напряженность силового поля (так как зависят от положения источников поля - зарядов и токов, не входящих в нашу систему), объем системы (так как определяется расположением внешних тел) и т.д. Следовательно, внешние параметры являются функциями координат внешних тел. Величины, определяемые совокупным движением и распределением в пространстве входящих в систему частиц, называются внутренними параметрами, например энергия, давление, плотность, намагниченность, поляризованность и т.д. (так как их значения зависят от движения и положения частиц системы и входящих в них зарядов).
Совокупность независимых макроскопических параметров определяет состояние системы, т.е. форму ее бытия. Величины не зависящие от предыстории системы и полностью определяемые ее состоянием в данный момент (т.е. совокупностью независимых параметров), называются функциями состояния. Состояние называется стационарным, если параметры системы с течением времени не изменяются. Если, кроме того, в системе не только все параметры постоянны во времени, но и нет никаких стационарных потоков за счет действия каких-либо внешних источников, то такое состояние системы называется равновесным (состояние термодинамического равновесия). Термодинамическими системами обычно называют не всякие, а только те макроскопические системы, которые находятся в термодинамическом равновесии. Аналогично, термодинамическими параметрами называются те параметры, которые характеризуют систему в термодинамическом равновесии.
Внутренние параметры системы разделяются на интенсивные и экстенсивные.
Параметры, не зависящие от массы и числа частиц в системе, называются
интенсивными (давление, температура и др.). Параметры, пропорциональные массе или числу частиц в системе, называются аддитивными или экстенсивными (энергия, энтропия и др.). Экстенсивные параметры характеризуют систему как целое, в то время как интенсивные могут принимать определенные значения в каждой точке системы.
По способу передачи энергии, вещества и информации между рассматриваемой системой и окружающей средой термодинамические системы классифицируются следующим образом:
1. Замкнутая (изолированная) система - это система, в которой нет
обмена с внешними телами ни энергией, ни веществом (в том числе и
излучением), ни информацией;
2. Закрытая система – система, в которой есть обмен только энергией;
3. Адиабатно изолированная система - это система, в которой есть обмен
энергией только в форме теплоты;
4. Открытая система - это система, которая обменивается и энергией, и
веществом, и информацией;
5.Открытые диссипативные системы.
Кинетическая теория газов является частью классической статистической физики и основана на следующих основных ее положениях:
1) в системе частиц выполняются законы сохранения импульса, момента импульса, энергии, электрического заряда и числа частиц (для закрытых систем, не претерпевающих химических реакций и других превращений);
2) все частицы системы считаются «мечеными», т.е. предполагается возможность отличать друг от друга тождественные частицы (например, молекулы одного и того же вещества);
3) все физические процессы в системе протекают в пространстве и времени непрерывно (например, под влиянием внешних воздействий энергия частицы меняется на любую величину, т.е. непрерывно);
4) каждая частица системы может иметь совершенно произвольные значения координат (в пределах объема системы) и компонент скорости совершенно независимо от того, какие значения этих характеристик у других частиц системы.
Для понимания макроскопических систем, состоящих из огромного числа частиц, необходимо сформулировать новые понятия, отвечающие такому новому качеству, как необычайная сложность системы. Эти понятия, основанные на фундаментальных законах микрофизики, позволяют указать параметры, наиболее удобные для описания макроскопических систем, установить закономерности, действующие в макроскопических системах, и дают относительно простые методы для количественного определения и предсказания свойств таких систем.
Статистическая физика при рассмотрении той или иной материальной системы изучает весьма общую ситуацию. Казалось бы, по данным о скоростях и координатах частиц можно оценить среднее значение (свойства) системы, решая уравнения механики для N независимых частиц системы. Однако такой чисто механический подход является неперспективным, потому что учет начальных условий для каждой частицы не представляется возможным, т.к. число частиц очень велико (только в одном моле вещества их NA =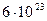 частиц). В общем же случае произвольной системы А, когда взаимодействие между частицами носит сложный характер, такой механический подход вообще трудно реализовать (много частиц и много уравнений, неизвестны начальные условия).
частиц). В общем же случае произвольной системы А, когда взаимодействие между частицами носит сложный характер, такой механический подход вообще трудно реализовать (много частиц и много уравнений, неизвестны начальные условия).
Состояние же термодинамической системы А в состоянии равновесия характеризуется набором постоянных параметров, которые совсем не зависят от начального набора координат частиц системы. Это связано с тем, что при дальнейшем росте числа частиц в системе А появляются качественно новые закономерности, не сводящиеся к механическим. Они называются статистическими и присущи всем системам с числом частиц N >>1. Исследование статистических закономерностей приводит к возможности расчета макросвойств системы А. Этот расчет опирается на свойства частиц, из которых состоит система А, на особенности их движения и взаимодействия между собой и окружающими телами. На основе этих молекулярно-кинетических представлений определяются макросвойства системы.
Термодинамика также изучает различные состояния вещества. В отличие от молекулярно - кинетической теории, термодинамика изучает макроскопические свойства тел без учета микроскопических характеристик. Не входя в микроскопическое рассмотрение процессов, термодинамика позволяет делать целый ряд выводов относительно их протекания.
Термодинамика и молекулярно-кинетическая теория рассматривают изменение состояния вещества с разных точек зрения и взаимно дополняют друг друга. Состояние некоторой массы газа определяется некоторыми параметрами, называемыми параметрами состояния. Такими параметрами являются давление p, объем V и температура T, которые функционально связаны, и изменение одного из них приводит к изменению других. Соотношение, которое определяет связь между параметрами некоторого тела, называется уравнением состояния идеального газа.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 466; Нарушение авторских прав?; Мы поможем в написании вашей работы!