
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Линейный закон роста пленки
|
|
|
|
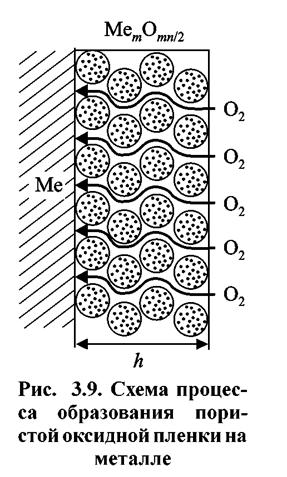
Рассмотрим случай, когда пленки не образуют сплошного и плотного слоя (Vок/Vме < 1), не являются защитными, и окисляющий газ может свободно проникать через них к поверхности металла и вступать с ним в химическую реакцию. Схематически такой процесс представлен на рис. 3.9.
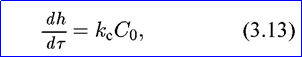 |
Скорость реакции в этом случае не зависит от толщины пленки и может быть выражена уравнением:
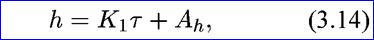 |
где h — толщина пленки на металле; τ — время коррозии металла; кс —константа скорости химической реакции; Со — концентрация окислителя на поверхности металла. После разделения переменных и интегрирования получим:
где Κ1 = kС Со — величина, постоянная для данной концентрации окислителя; Аh — постоянная интегрирования, численно равная толщине пленки перед опытом.
 |  | ||
В большинстве опытов значение постоянной Аh близко к нулю, и тогда уравнение (3.14) принимает вид:
Таким образом, рост пористой (незащитной) пленки контролируется скоростью химической реакции окисления (кинетический контроль) и протекает во времени по линейному закону.
Линейный закон наблюдается при высокотемпературном окислении на воздухе щелочных и щелочноземельных металлов, а также металлов, оксиды которых возгоняются при высоких температурах (например, вольфрам, молибден). В качестве примера на рис. 3.10 приведены экспериментальные кривые окисления магния.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 427; Нарушение авторских прав?; Мы поможем в написании вашей работы!