
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры
|
|
|
|
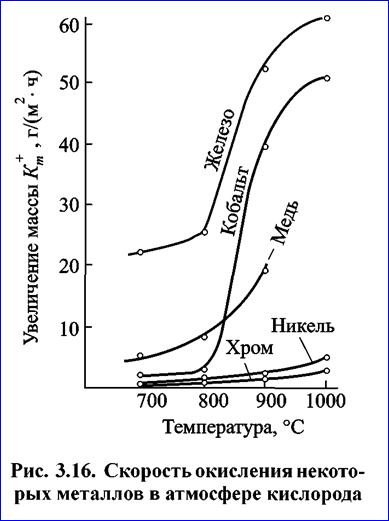
Температура оказывает значительное влияние на процессы газовой коррозии. Как было показано ранее, термодинамическая вероятность осуществления большинства реакций, которые приводят к образованию защитных пленок, с повышением температуры падает. В то же время рост температуры способствует увеличению скорости реакции. Поэтому в пределах термодинамической возможности (когда значение энергии Гиббса AG0 меньше нуля) с увеличением температуры скорость коррозии возрастает (рис. 3.16).
Температура оказывает влияние на константу скорости химической реакции и на коэффициент массопередачи в процессе диффузии.
Для обоих случаев имеет место экспоненциальная зависимость:
K = AeE/RT, (3.25)
 |
где K — константа скорости химической реакции или коэффициент диффузии; А — постоянная, формально равная K при экстраполяции на 1/Т = 0; Ε — энергия активации химической реакции или процесса диффузии; R — газовая постоянная, равная 8,32 кДж/моль; Τ — абсолютная температура.
Если прологарифмировать уравнение (3.25), то получим:
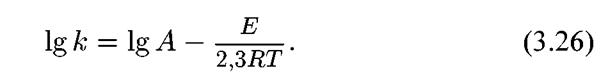
Таким образом, температурная зависимость в координатах 1/Т — lg к выражается прямой линией, для которой E/2,3RT равно тангенсу угла наклона.
При окислении металлов могут наблюдаться случаи, когда при невысоких температурах процесс идет в кинетической области, т.е. лимитируется скоростью химической реакции. При повышении температуры коэффициент скорости химической реакции возрастает в несколько раз быстрее, чем коэффициент диффузии. Это приводит к тому, что при определенной температуре (для многих металлов — 800-900°С) скорость химической реакции уравнивается со скоростью диффузии, а потом и превышает ее. Процесс начинает контролироваться стадией диффузии. На зависимости \gk — 1/Т этот эффект будет отмечен изломом, изменением наклона прямой линии.
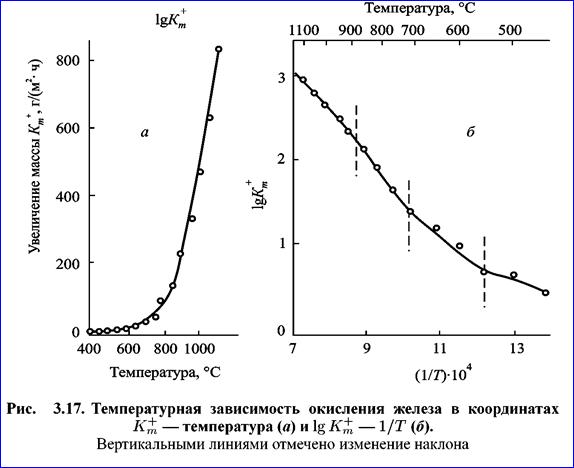
Температура может оказывать также влияние на состав образующихся пленок. На рис. 3.17 приведена температурная зависимость окисления железа на воздухе, а в табл. 3.5 — состав образующихся пленок.

Как показывают экспериментальные данные (рис. 3.17), в координатах
lg K- 1/Т отмечено четыре участка (ограничены штриховой линией) с изменением наклона. Три нижние участка отвечают изменению состава оксидной пленки и кинетическому закону роста. Верхний участок, при температуре более 800 °С может быть связан с изменением лимитирующей стадии процесса.
Колебания температуры при нагреве металла, попеременные нагрев и охлаждение увеличивают скорость окисления металлов. В оксидной пленке возникают термические напряжения, образуются трещины и она начинает отслаиваться от металла.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 505; Нарушение авторских прав?; Мы поможем в написании вашей работы!