
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Систематика элементарных частиц
|
|
|
|
3.4
3.2
Еще в античные времена возникло представление об атомахкак неделимых мельчайших частицах вещества («атомос» - неразложимый). К началу XVIII в. существование атомов было доказано, но атомы по-прежнему считались неделимыми. В 1869 г. Д. И. Менделеев разработал Периодическую систему элементов, отражающую единую природу атомов. Напрашивался вывод о том, что атом имеет сложное строение. Когда было доказано, что электрон является составной частью любого атома, встал вопрос о строении атома. Результаты исследований свойств электрона и радиоактивности позволили строить конкретные модели атома.
Открытие строения атома принадлежит английскому физику Резерфорду. Он исследовал прохождение α-частиц в веществе через золотую фольгу толщиной примерно 1 мкм. α–частицы - положительно заряженные частицы с зарядом 2 е - и массой, примерно в 7300 раз большей массы электрона. Проходя через фольгу, основная их часть незначительно отклонилась. Но совершенно неожиданно оказалось, что примерно 1 частица из 20000 возвращается назад в сторону источника. Легкие электроны не могут существенно изменить движение тяжелых и быстрых частиц. Значительное отклонение α–частиц обусловлено тем, что они наталкиваются на тяжелую частицу с положительным зарядом. Объем этой тяжелой частицы очень мал по сравнению с объемом атома, так как сильно отклоняются лишь немногие α–частицы. Чтобы объяснить результаты опытов Резерфорд в 1911 г. предложил принципиально новую модель атома, напоминающую по строению Солнечную систему - планетарную (ядерную) модель атома. Согласно этой модели положительно заряженная часть атома не распределена по всему его объему, а сосредоточена в чрезвычайно малом объеме - ядре атома (размер – 10-15 … 10-14 м). Вокруг положительного ядра, имеющего заряд Ze (Z – порядковый номер элемента в системе Менделеева, е - элементарный заряд), по замкнутым орбитам движутся электроны, подобно планетам вокруг Солнца, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов. В атоме действуют электрические (кулоновские) силы.
Датский физик Нильс Бор в 1913 г. предпринял смелую попытку объяснить результаты анализа спектра атома водорода. Это была первая попытка построить качественно новую (квантовую) теорию атома.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергию. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
mevrn = nħ, (n = 1, 2, 3, …), (4.3)
где m e - масса электрона, v - его скорость на n -й орбите. Стационарные состояния соответствуют дискретному (прерывному) ряду дозволенных значений энергии E n.
Второй постулат Бора ( правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
h ν = En - Em (4.4)
Энергия фотона равна разности энергий соответствующих стационарных состояний (Еn и Еm — соответственно энергии стационарных состояний атома до и после излучения (поглощения)). При Em < En происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией. При Еm > Еn - его поглощение (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту.
Электрон движется вокруг ядра по круговой орбите радиуса r (с центростремительным ускорением). Согласно классической электродинамике ускоренно движущийся электрон должен непрерывно излучать электромагнитные волны, терять энергию на излучение и упасть на ядро. Однако этого не происходит. Другая трудность состояла в следующем: если принять, что частота излучаемого электроном света равна частоте колебаний электрона в атоме (или числу оборотов в одну секунду), то излучаемый свет по мере приближения электрона к ядру должен непрерывно изменять свою частоту. Соответственно спектр излучаемого света должен быть сплошным (в нем должны присутствовать все частоты). Но это противоречит опыту. Атом излучает волны вполне определенных частот, типичных для данного химического элемента, и характеризуется спектром, состоящим из отдельных спектральных линий – линейчатым спектром (рис.4.1).

|
Исследования спектров излучения разреженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома — атома водорода. Линии объединены в группы, которые принято называть сериями (на рис.43 дана серия Бальмера в спектре атома водорода, длины волн указаны в ангстремах). Расстояние между линиями уменьшается с увеличением длины волны.
Швейцарский ученый И. Бальмер (1885 г.)
Все серии линий в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:
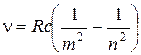 , (4.2)
, (4.2)
где R = 1,10·107м-1 - постоянная Ридберга, m имеет в каждой данной серии постоянное значение, т = 1, 2, 3, 4, 5, 6 (определяет серию), п принимает целочисленные значения начиная с (т+ 1) (определяет отдельные линии этой серии).
Набор возможных дискретных частот ν = (En - Em) /h квантовых переходов и определяет линейчатый спектр атома. Величина n называется главным квантовым числом.
Энергетическое состояние с n = 1 является основным (нормальным ) состоянием; состояния с n > 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными.
Энергия атома водорода с увеличением n возрастает, и энергетические уровни сближаются. Атом водорода обладает, таким образом, минимальной энергией (E 1= – 13,55 эВ) при n = 1 и максимальной (E max = 0) при n = ∞. Следовательно, значение E max = 0 соответствует ионизации атома (отрыву от него электрона).
Если m = 1 и n = 2, 3, 4,..., получим группу линий, образующих серию Лаймана и соответствующих переходам электронов с возбужденных уровней (n = 2, 3, 4,...) на основной (m = l). Аналогично, при подстановке т = 2, 3, 4, 5, 6 и соответствующих им значений n = 3, 4, 5, 6, 7 получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри (часть из них схематически представлена на рис.4.2).
В 1924 г. французский физик Луи Виктор де Бройль выдвинул предположение, что наряду с корпускулярным поведением волн должно обнаруживаться волновое поведение частиц.
Де Бройль предположил, что точно тем же соотношением должна определяться длина волны, отвечающая движению частицы вещества. Длина волны де Бройля:
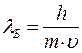 .
.
Не прошло и трех лет со времени появления гипотезы де Бройля, как волновые свойства электрона были обнаружены в экспериментах по дифракции электронного потока на кристаллах (в качестве дифракционных решеток). Позже были обнаружены волновые свойства у других частиц, а также у атомов и ионов.
Применять классические соображения к объектам частица-волна и отдельным событиям микромира стало невозможно. В связи с этим немецкий физик Вернер Гейзенберг пришел к мысли о том, что в природе должен существовать общий принцип, ограничивающий возможности любых экспериментов (невозможно, например, точно определить положение и скорость такой частицы-волны в пространстве). Этот принцип, сформулированный в 1927 г., получил название принципа неопределенности.
Гейзенбергом получены соотношения, количественно выражающие эту неопределенность:
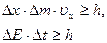 . (4.11)
. (4.11)
Смысл первого выражения состоит в том, что, чем более точно локализована микрочастица, тем с меньшей точностью мы знаем ее импульс. И наоборот, если мы определяем с высокой точностью импульс (скорость) частицы (электрона, например), то такое измерение лишает нас возможности точно узнать, где находится частица после измерения. Согласно классической теории, частица в каждый момент занимает вполне определенное положение и имеет точно определенную скорость движения. Попытаемся применить эти представления к элементарной частице электрону.
Локализуем электрон в одном измерении. Для этого пропустим пучок электронов через узкую щель. Неопределенность положения электрона равна ширине щели. При прохождении через щель электронные волны дифрагируют, образуя на экране дифракционную картину. Неизвестно, в какое место экрана попадет отдельный электрон. Дифракция вносит неопределенность в значение импульса отдельного электрона.
Идея де Бройля послужила исходным пунктом квантовой механики, созданной в 1926 - 1927 г. трудами В. Гейзенберга, М. Борна, Э. Шредингера, и П. Дирака.
Наличие волновых свойств у микрочастиц сделало невозможным трактовку их как механических частиц. Уравнения движения Ньютона, описывающие движение макрочастиц, непригодны для описания движения микрочастиц. Теория, описывающая движение микрочастиц, должна учитывать все их свойства, корпускулярные и волновые.
Де Бройль, предположивший наличие волновых свойств у частиц, такой теории не создал. Он не нашел уравнения, которое явилось бы для микрочастиц тем, чем является уравнение Ньютона для макроскопических тел. Такое уравнение было найдено Шредингером в 1926 г. Так же как и уравнение Ньютона, уравнение Шредингера не выводится. Оно постулируется, и его правильность определяется тем, в какой мере его применение подтверждается результатами опыта. Уравнение Шредингера, определяющее поведение микрочастицы, коренным образом отличается от уравнения Ньютона.
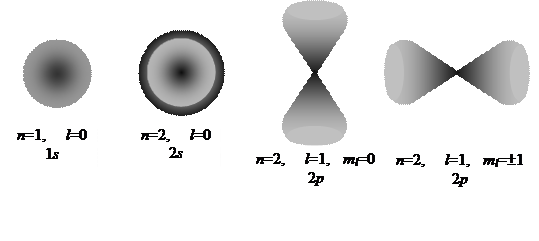
Согласно квантовому представлению для электрона существует лишь электронная плотность вероятности в виде облака, симметрично расположенного около ядра. Электрон не находится на каком - то точно определенном расстоянии от ядра, не существует электронных «орбит», а вместо этого имеется размытое электронное распределение рис. 4.3. Можно указать лишь вероятность того, что электрон находится на данном расстоянии от ядра.
|
Собственный момент импульса электрона называют спином.
Спин – векторная величина
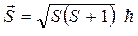 , (4.18)
, (4.18)
в которой S – спиновое квантовое число, имеющее только одно значение S = 1/2. Поэтому существуют только две разрешенные проекции на выбранное направление S Z = mSћ; mS = +1/2, -1/2.
Итак, состояние электрона определяют четыре квантовых числа 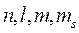 .
.
Ключ к решению проблемы оболочечной структуры атома был найден Паули в 1925 г. На каждой оболочке находится ограниченное число электронов. Паули считал, что такое ограничение должно иметь фундаментальную причину и сформулировал следующий принцип (принцип запрета или принцип Паули).
Принцип Паули: в атоме (как и в любой квантовой системе) не может существовать двух электронов с одинаковым набором квантовых чисел.
Согласно этому принципу, в каждом электронном состоянии в атоме может находиться только один электрон. Если данное состояние уже занято, то последующий электрон, входя в состав атома, вынужден занимать другое состояние.
3.3
Атом состоит из положительно заряженного ядра и окружающих его электронов. Атомные ядра имеют размеры примерно 10 -14… 10 -15 м (линейные размеры атома – 10-10 м).
Атомное ядро состоит из элементарных частиц - протонов и нейтронов. Протонно-нейтронная модель ядра была предложена российским физиком Д. Д. Иваненко, а впоследствии развита В. Гейзенбергом.
Протон (р) имеет положительный заряд, равный заряду электрона, и массу покоя тp= 1,6726∙10-27 кг 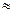 1836 m e, где me - масса электрона. Нейтрон (n) - нейтральная частица с массой покоя mn = 1,6749∙10-27 кг
1836 m e, где me - масса электрона. Нейтрон (n) - нейтральная частица с массой покоя mn = 1,6749∙10-27 кг 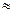 1839 тe,. Массу протонов и нейтронов часто выражают в других единицах – в атомных единицах массы (а.е.м., единица массы, равная 1/12 массы атома углерода
1839 тe,. Массу протонов и нейтронов часто выражают в других единицах – в атомных единицах массы (а.е.м., единица массы, равная 1/12 массы атома углерода 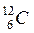 ). Массы протона и нейтрона равны приблизительно одной атомной единице массы. Протоны и нейтроны называются нуклонами (от лат. nucleus - ядро). Общее число нуклонов в атомном ядре называетсямассовым числом А).
). Массы протона и нейтрона равны приблизительно одной атомной единице массы. Протоны и нейтроны называются нуклонами (от лат. nucleus - ядро). Общее число нуклонов в атомном ядре называетсямассовым числом А).
Радиусы ядер возрастают с увеличением массового числа в соответствии с соотношением R = 1,4 А 1/310-13 см.
Эксперименты показывают, что ядра не имеют резких границ. В центре ядра существует определенная плотность ядерного вещества, и она постепенно уменьшается до нуля с увеличением расстояния от центра. Из-за отсутствия четко определенной границы ядра его «радиус» определяется как расстояние от центра, на котором плотность ядерного вещества уменьшается в два раза. Среднее распределение плотности материи для большинства ядер оказывается не просто сферическим. Большинство ядер деформировано. Часто ядра имеют форму вытянутых или сплющенных эллипсоидов.
Атомное ядро характеризуется зарядом Ze, где Z - зарядовое число ядра, равное числу протонов в ядре и совпадающее с порядковым номером химического элемента в Периодической системе элементов Менделеева.
Ядро обозначается тем же символом, что и нейтральный атом: 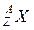 , где X - символ химического элемента, Z - атомный номер (число протонов в ядре), А - массовое число (число нуклонов в ядре). Массовое число А приблизительно равно массе ядра в атомных единицах массы.
, где X - символ химического элемента, Z - атомный номер (число протонов в ядре), А - массовое число (число нуклонов в ядре). Массовое число А приблизительно равно массе ядра в атомных единицах массы.
Ядра с одинаковыми зарядовыми числами Z, но с разными массовыми числами А (т. е. с разными числами нейтронов N = A – Z), называются изотопами, а ядра с одинаковыми А, но разными Z – изобарами. Например, водород (Z = l) имеет три изотопа: 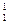 Н – протий (Z = l, N = 0),
Н – протий (Z = l, N = 0), 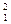 Н – дейтерий (Z = l, N = 1),
Н – дейтерий (Z = l, N = 1), 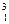 Н – тритий (Z = l, N = 2), олово – десять изотопов и т. д. В подавляющем большинстве случаев изотопы одного и того же химического элемента обладают одинаковыми химическими и почти одинаковыми физическими свойствами.
Н – тритий (Z = l, N = 2), олово – десять изотопов и т. д. В подавляющем большинстве случаев изотопы одного и того же химического элемента обладают одинаковыми химическими и почти одинаковыми физическими свойствами.
Исследования показывают, что атомные ядра являются устойчивыми образованиями. Это означает, что в ядре между нуклонами существует определенная связь.
Измерения показали, что масса ядра меньше, чем сумма масс составляющих его нуклонов.
Величина
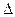 m = [ Zm p + (А–Z) m n] – m я, (5.1)
m = [ Zm p + (А–Z) m n] – m я, (5.1)
называется дефектом массы ядра. На эту величину уменьшается масса всех нуклонов при образовании из них атомного ядра.
Согласно соотношению Эйнштейна между массой и энергией
E=mc 2 (5.2)
всякому изменению массы должно соответствовать изменение энергии. Следовательно, при образовании ядра должна выделяться определенная энергия. Из закона сохранения энергии вытекает и обратное: для разделения ядра на составные части необходимо затратить такое же количество энергии, которое выделяется при его образовании. Энергия, которую необходимо затратить, чтобы расщепить ядро на отдельные нуклоны, называется энергией связи ядра.
Между составляющими ядро нуклонами действуют особые, специфические для ядра силы, значительно превышающие кулоновские силы отталкивания между протонами. Ониназываются ядерными силами.
Перечислим основные свойства ядерных сил:
1) ядерные силы являются силами притяжения;
2) ядерные силы являются короткодействующими – их действие проявляется только на расстояниях примерно 10-15 м. При увеличении расстояния между нуклонами ядерные силы быстро уменьшаются до нуля, а при расстояниях, меньших их радиуса действия, оказываются примерно в 100 раз больше кулоновских сил, действующих между протонами на том же расстоянии;
3) ядерным силам свойственна зарядовая независимость: ядерные силы, действующие между двумя протонами, или двумя нейтронами, или, наконец, между протоном и нейтроном, одинаковы по величине. Отсюда следует, что ядерные силы имеют неэлектрическую природу;
4) ядерным силам свойственно насыщение, т. е. каждый нуклон в ядре взаимодействует только с ограниченным числом ближайших к нему нуклонов. Насыщение проявляется в том, что удельная энергия связи нуклонов в ядре (если не учитывать легкие ядра) при увеличении числа нуклонов не растет, а остается приблизительно постоянной;
5) ядерные силы зависят от взаимной ориентации спинов взаимодействующих нуклонов. Например, протон и нейтрон образуют дейтрон (ядро изотопа 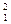 H) только при условии параллельной ориентацииих спинов;
H) только при условии параллельной ориентацииих спинов;
6) ядерные силы не являются центральными, т. е. действующими по линии, соединяющей центры взаимодействующих нуклонов.
Французский физик А. Беккерель (1852 - 1908) в 1896 г. при изучении люминесценции солей урана случайно обнаружил самопроизвольное испускание ими излучения неизвестной природы, которое действовало на фотопластинку, ионизировало воздух, проникало сквозь тонкие металлические пластинки, вызывало люминесценцию ряда веществ. Продолжая исследование этого явления, супруги Кюри - Мария и Пьер - обнаружили, что такое излучение свойственно не только урану, но и многим другим тяжелым элементам, таким, как торий и актиний. Удалось выделить два новых элемента - носителя беккерелевского излучения: полоний 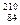 Рo и радий
Рo и радий 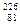 Ra.
Ra.
Обнаруженное излучение было названо радиоактивным, а само явление - испускание радиоактивного излучения - радиоактивностью.
Радиоактивные свойства элемента обусловлены лишь структурой его ядра.
В настоящее время под радиоактивностью понимают способность некоторых атомных ядер самопроизвольно (спонтанно) превращаться в другие ядра с испусканием различных видов радиоактивных излучений и элементарных частиц. Атомное ядро, испытывающее радиоактивный распад, называется материнским, возникающее ядро - дочерним.
Радиоактивность подразделяется на естественную (наблюдается у неустойчивых изотопов, существующих в природе) и искусственную (наблюдается у изотопов, полученных посредством ядерных реакций). Принципиального различия между этими двумя типами радиоактивности нет, так как законы радиоактивного превращения в обоих случаях одинаковы.
При своем распаде ядра могут испускать радиоактивное излучение трех типов. В соответствии с этим рассматривают 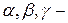 распад.
распад.
При a-распаде ядро испускает a-частицу, которая представляет собой ядро изотопа гелия 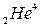 . a-излучение отклоняется электрическим и магнитным полями, обладает высокой ионизирующей способностью и малой проникающей способностью (например, поглощаются слоем алюминия толщиной примерно 0,05 мм). Скорость a-частиц
. a-излучение отклоняется электрическим и магнитным полями, обладает высокой ионизирующей способностью и малой проникающей способностью (например, поглощаются слоем алюминия толщиной примерно 0,05 мм). Скорость a-частиц 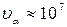 м/с. Если символом
м/с. Если символом 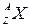 обозначить материнское ядро, то превращение ядра при a-распаде происходит по схеме:
обозначить материнское ядро, то превращение ядра при a-распаде происходит по схеме:
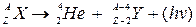 ,
,
где 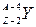 – символ дочернего ядра. a-распад уменьшает массовое число на 4, а заряд ядра – на 2 элементарных положительных заряда, то есть происходит перемещение химического элемента на две клетки влево в периодической системе элементов Менделеева. Например,
– символ дочернего ядра. a-распад уменьшает массовое число на 4, а заряд ядра – на 2 элементарных положительных заряда, то есть происходит перемещение химического элемента на две клетки влево в периодической системе элементов Менделеева. Например, 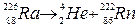 .
.
b-Распад сопровождается испусканием электронов (b-лучи), которые при этом имеют огромные скорости, близкие к скорости света. b-Излучение отклоняется электрическим и магнитным полями; его ионизирующая способность значительно меньше (примерно на два порядка), а проникающая способность гораздо больше (поглощается слоем алюминия толщиной примерно 2 мм), чем у a-частиц. b-Излучение сильно рассеивается в веществе. Массовое число при b-распаде не изменяется, а зарядовое число увеличивается на единицу: 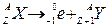 .
.
Следовательно, новый химический элемент перемещается на одну клеточку вправо в периодической системе Менделеева.
g-Распад сопровождается коротковолновым электромагнитным излучение с чрезвычайно малой длиной волны l<10-10 м и вследствие этого – ярко выраженными корпускулярными свойствами. т.е. g-излучение является потоком частиц – g-квантов (фотонов). g-Излучение не отклоняется электрическим и магнитным полями, обладает относительно слабой ионизирующей способностью и очень большой проникающей способностью (например, проходит через слой свинца толщиной 5 см), при прохождении через кристаллы обнаруживает дифракцию.
Распад естественных и искусственных радиоактивных элементов осуществляется по одному закону. Опыт показывает, что количество радиоактивных атомов N(t) убывает со временем по экспоненциальному закону:
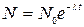 (5.5)
(5.5)
где l–постоянная радиоактивного распада, характерная для каждого вещества. Она численно равна обратной величине времени, за которое число радиоактивных атомов уменьшается в е раз. На практике чаще пользуются не постоянной распада, а период полураспада Т, т.е. временем, в течение которого число радиоактивных ядер в среднем уменьшается вдвое. Значения Т для различных изотопов лежат в очень широких пределах: от 10-16с до миллиардов лет. На законе радиоактивного распада основан способ определения возраста земных пород, остатков растений, организмов и т.п.
В настоящее время элементарными частицами называют большую группу мельчайших частиц материи, которые не являются атомами или атомными ядрами (за исключением протона — ядра атома водорода) и которые при взаимодействии ведут себя как единое целое. Характерным свойством всех элементарных частиц является их способность к взаимным превращениям (рождению и уничтожению) при взаимодействии с другими частицами.
Ситуация с определением элементарности усложнилась после того, как выяснилось, что многие из этих частиц имеют внутреннюю структуру.
Известны четыре вида взаимодействий (фундаментальные взаимодействия) между элементарными частицами: сильное, электромагнитное, слабое и гравитационное.
Эти взаимодействия отличаются интенсивностью процессов, вызываемых среди элементарных частиц. Об интенсивности взаимодействий можно судить по скорости (или степени вероятности) процессов, вызываемых ими. Обычно для сравнения берут скорости процессов при энергиях сталкивающихся частиц около 1 ГэВ (такая энергия характерна для физики элементарных частиц). Сравнительные характеристики этих четырех типов взаимодействия приведены в табл. 6.1, где указаны интенсивности взаимодействий по сравнению с сильным, принятым за единицу, а также длительность процессов и радиус действия соответствующих сил.
| Взаимодействие | Интенсивность | Длительность процессов, с | Радиус действия, см |
| Сильное Электромагнитное Слабое Гравитационное | ~10-2 10-5 10-39 | 10-24 10-20 > 10-8 ? | 10-13 ∞ 10-16 ∞ |
Сильные взаимодействия обеспечивают связь нуклонов в ядре и удерживают нуклоны в атомных ядрах. Расстояние, на котором проявляется сильное взаимодействие (радиус действия r), составляет примерно 10-13 см. Сильное взаимодействие выступает исключительно в качестве сил притяжения.
Электромагнитное взаимодействие значительно слабее сильных взаимодействий, однако из-за дальнодействия электромагнитные силы во многих случаях оказываются главными. Именно эти силы вызывают разлет осколков, которые образуются при делении атомных ядер. Эти силы ответственны за все электрические и магнитные явления, наблюдаемые нами в различных формах их проявления: оптических, механических, тепловых, химических и т. д. Электромагнитные силы могут быть как силами притяжения (между разноименно заряженными частицами), так и силами отталкивания (между одноименно заряженными частицами).
Слабое взаимодействие ответственно за все виды β-распада ядер, за все процессы взаимодействия нейтрино с веществом, а также за многие распады элементарных частиц. Слабое взаимодействие гораздо слабее не только сильного, но и электромагнитного взаимодействия. Слабое взаимодействие, как и сильное, является короткодействующим.
Гравитационное взаимодействие является универсальным и самым слабым. Ему подвержены все элементарные частицы. Радиус действия не ограничен (r = ∞). Однако в процессах микромира гравитационное взаимодействие ощутимой роли не играет. Гравитационные силы проявляют себя как силы притяжения.
Для элементарных частиц весьма характерна их многочисленность. В настоящее время открыто несколько сотен частиц, подавляющее большинство которых нестабильно.
По времени жизни τ различают стабильные, квазистабильные и так называемые резонансы. Резонансами называют короткоживущие частицы, распадающиеся за счет сильного взаимодействия с временем жизни ~ 10-23 с. Нестабильные частицы с временем жизни, превышающим 10-20 с, распадаются за счет электромагнитного или слабого взаимодействия. По сравнению с характерным ядерным временем (10-23 с) время 10-20 следует считать большим. По этой причине их и называют квазистабильными. Стабильными же частицами (τ → ∞) являются только фотон, электрон, протон и нейтрино.
Переносчики взаимодействия. Это особая группа элементарных частиц, в которую входят фотоны (переносчики электромагнитного взаимодействия), промежуточные векторные бозоны (переносчики слабого взаимодействия), так называемые глюоны (переносчики сильного взаимодействия) и гипотетические гравитоны (переносчики гравитационного взаимодействия).
Внастоящее время элементарные частицы делятся на большие классы и подклассы в зависимости от типов фундаментальных взаимодействи й, в которых эти частицы участвуют.
Элементарные частицы объединены в три группы: фотоны, лептоны и адроны. Естественно, что отнесенные к каждой из этих групп элементарные частицы обладают общими свойствами и характеристиками, которые отличают их от частиц другой группы.
1. Фотоны (γ) - (кванты электромагнитного поля) участвуют в электромагнитных взаимодействиях, но не обладают сильным и слабым взаимодействиями.
2. Лептоны. Это частицы, не участвующие в сильных взаимодействиях и имеющие спин 1/2. К ним относятся электроны (е), мюоны (μ), таоны (τ) и соответствующие им нейтрино (νе,, νμ,, ντ). Лептоны принимают участие в слабых взаимодействиях. За исключением нейтрино, лептоны участвуют и в электромагнитных взаимодействиях. Все лептоны можно отнести к истинно элементарным частицам, поскольку у них, в отличие от адронов, не обнаружена внутренняя структура.
3. Адроны. Так называют элементарные частицы, участвующие в сильных взаимодействиях. Как правило, они участвуют и в электромагнитном, и в слабом взаимодействиях. Эти частицы образуют многочисленную группу частиц (свыше 400). Адроны подразделяют на мезоны и барионы.
3.1. Мезоны — это адроны с нулевым или целочисленным спином (т. е. бозоны). К ним относятся π-, К- и η-мезоны, а также множество мезонных резонансов, т. е. мезонов с временем жизни ~ 10-23 с.
3.2. Барионы — это адроны с полуцелым спином (т. е. фермионы) и массами, не меньшими массы протона. К ним относятся нуклоны (протоны и нейтроны), гипероны и множество барионных резонансов. За исключением протона, все барионы нестабильны. Нестабильные барионы с массами, большими массы протона, и большим временем жизни (сравнительно с ядерным ~ 10-23 с) называют гиперонами. Это гипероны Λ, Σ, Ξ и Ω. Все гипероны имеют спин 1/2, за исключением Ω, спин которого 3/2. За время τ ~ 10-10 ÷ 10-19 с они распадаются на нуклоны и легкие частицы (π-мезоны, электроны, нейтрино, γ-кванты).
Сведем для наглядности основную систематику элементарных частиц в табл. 6.2.
Таблица 6.2
| Фотоны | Лептоны | Адроны | ||
| Мезоны | Барионы | |||
| Нуклоны | Гипероны | |||
| γ | е, μ, τ, νе, νμ, ντ | π, К, η и резонансы | p, n | Λ, Σ, Ξ, Ω и резонансы |
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 548; Нарушение авторских прав?; Мы поможем в написании вашей работы!