
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второе начало термодинамики
|
|
|
|
Направление химических реакций.
Лекция 3
Химическая термодинамика важна не только тем, что служит научной основой получения и преобразования энергии. Она также объясняет причины самопроизвольного протекания реакций и установления химического равновесия. Позволяет прогнозировать возможность осуществления каких угодно реакций на основе термодинамических констант исходных веществ (реагентов) и продуктов реакции. Термодинамика показывает, что энергия лишь косвенным образом связана с направлением реакций, а, в конечном счете, направление процессов определяется возрастанием энтропии S – термодинамической функции, которую наиболее просто рассматривать как меру неупорядоченности системы.
В окружающем мире мы наблюдаем множество необратимых и, следовательно, самопроизвольных процессов. Проходят свой жизненный путь люди. Ветшают и разваливаются стены зданий. Образуются выбоины на дорогах. Непрерывно расширяется Вселенная. Вы, наверно, знаете об этом. В небольших масштабах (в химической колбе, заводской установке), можно изменить направление процесса на обратное. Для этого необходимо затратить работу. Самопроизвольное горение водорода в кислороде с образованием воды может использоваться для работы двигателей, но разложение воды на водород и кислород самопроизвольно не идет, и осуществляется в процессе электролиза воды с затратой работы.
Анализируя ход самопроизвольных процессов, можно заметить, что они связаны с возрастанием неупорядоченности. Если рассыпать подобранную по мастям колоду карт, а потом снова собрать их в стопку, то карты окажутся сильно перемешанными, неупорядоченными. Почему это так? Потому что неупорядоченное состояние реализуется огромным числом вариантов. Это рассуждение можно приложить и к атомно-молекулярным системам, но с учетом того, что при гигантском числе структурных элементов вероятность неупорядоченных состояний в них несопоставимо больше.
Перехожу к рассмотрению энтропии.
Энтропия. Как получить количественное выражение энтропии? Из двух форм передачи энергии (Q, W) работу можно измерить произведением двух факторов – интенсивного и экстенсивного:
W = F×s, сила – интенсивный фактор, путь – экстенсивный
W = p ×DV, давление – интенсивный, объем – экстенсивный
W = U×q, электрический потенциал – интенсивный, количество электричества – экстенсивный.
То же самое должно быть справедливо и для теплоты. Она выражается произведением температуры (фактор интенсивности) на изменение фактора экстенсивности, который и есть энтропия:
Q ~ T×DS
Изменение энтропии зависит от характера процесса:
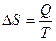
для обратимого процесса, и
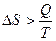
для необратимого процесса.
Связь теплоты с неупорядоченностью системы заметна не сразу. Но, учитывая, что теплота это энергия хаотического движения микрочастиц (молекул и др.), можно понять, что эта связь должна существовать.
Разработан также статистический подход к энтропии, основанный на понятии термодинамической вероятности W – это число микросостояний системы, которыми реализуется данное макросостояние (В случае колоды карт макросостояние, называемое «перемешанной колодой», реализуется множеством порядка 36! случайных последовательностей).
Рассмотрим газ. Смесь кислорода и азота находится при внешних параметрах р и Т в определенном состоянии. При этом молекулы движутся и сталкиваются, меняют координаты и скорость, и возникает совокупность не тождественных микросостояний частиц при одном и том же макросостоянии системы. Микросостояния с непостижимой быстротой сменяют друг друга, а система как целое находится в неизменном состоянии.
Энтропия системы выражается формулой
S = k ×lnW
где k = 1,38×10–23 Дж/К – постоянная Больцмана.
Для многих видов систем может быть определено абсолютное значение энтропии на основе постулата (3-е начало термодинамики): энтропия идеального кристалла при абсолютном нуле температуры равна нулю. Тогда для вычисления энтропии следует определять теплоемкость вещества и интегрировать выражение
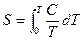
Энтропия вещества последовательно возрастает при переходе от твердого к жидкому и газообразному состоянию, так как при этих фазовых переходах поглощается теплота и растет неупорядоченность. В реакциях энтропия изменяется особенно сильно при изменении количества вещества газов. В таких случаях знак D S можно определять без вычисления.
O2(г) + Hb(aq) = HbO2(aq), DS < 0
(символ aq – вещество в растворе)
Здесь газ переходит в жидкую фазу, энтропия уменьшается.
Стандартная энтропия вещества S °, Дж/моль×К – энтропия 1 моль вещества при стандартных условиях.
Стандартное изменение энтропии в химической реакции
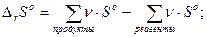
Уравнение аналогично следствию из закона Гесса.
Второе начало термодинамики.
Невозможен самопроизвольный переход теплоты от тела с более низкой температурой к телу с более высокой температурой.
Никто не станет это оспаривать. Этот факт не просто наблюдение из жизни, а проявление закона природы. Он возведен в ранг одного из определений второго начала термодинамики.
Есть и такое определение: невозможен вечный двигатель 2-го рода. Что дают эти определения для химии? Подразумевается, что цепочка рассуждений на основе любого определения приводит к правильному выводу о направлении изучаемого процесса.
Пример к вечному двигателю 2-го рода.
Ставим на колеса бочку, наполняем водой, устанавливаем вечный двигатель и едем на дачу, используя тепловую энергию воды на вращение колес. Приехали. В бочке уже не вода, а лед. Он пригодится в дачном хозяйстве. К сожалению, из термодинамики следует, что двигатель, работающий на этом принципе, невозможен.
Ближе к химии следующее определение второго начала термодинамики, непосредственно связанное с энтропией: в изолированных системах возможны лишь такие процессы, в которых энтропия возрастает или остается постоянной.
D S ³ 0,
где знак «больше» – относится к необратимому процессу, а знак «равно» – к обратимому.
Это чрезвычайно важное положение, которое пытались оспаривать философы. Напомню, что энергия Вселенной сохраняется. Это как бы свидетельствует о стабильности и вечности. Рост же энтропии означает старение Вселенной и прекращение самопроизвольных процессов при достижении максимальной энтропии. Однако энтропия еще не достигла своего максимума, и поэтому минувшее время не может быть вечностью. Оно началось 15 – 20 млрд. лет назад с момента «Большого взрыва».
Наиболее обычны системы, обменивающиеся энергией с окружающей средой, то есть закрытые. К ним особенно важно применить 2-е начало термодинамики. Переход теплоты из системы в окружающую среду ведет к уменьшению энтропии системы. Следовательно, определение второго начала термодинамики для изолированной системы нельзя непосредственно применить к закрытой системе. Возникает необходимость вывести критерий самопроизвольного протекания процессов в таких системах. Рассмотрим систему вместе с прилегающей областью окружающей среды. В системе идет процесс – химическая реакция. При этом изменяется энтальпия и энтропия.
ч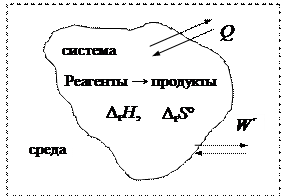
Представим теплоту процесса и изменение энтропии:
| В системе | В среде |
| Q = DrH + W ′ по I началу термодинамики | Q = -DrH - W ′ |
| Dr S | DS ³ 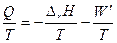
|
Система и среда вместе – изолированная система. Для нее по второму началу термодинамики
D S изол = S D S ³ 0
Подставляем сумму из правой и левой колонок таблицы:
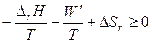
Меняем знак, умножаем на Т и переносим полезную работу в правую часть неравенства:
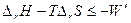
Слагаемые в левой части рассматриваются в качестве изменения особой функции состояния, называемой энергией Гиббса:
G º H – TS, DG = DH – TDS
Итак, из условия общего возрастания энтропии в самопроизвольном процессе в изолированной системе, мы получили критерий самопроизвольного протекания процесса в закрытой системе:
D G £ - W ′
В необратимом процессе полезная работа не совершается, и, следовательно, энергия Гиббса убывает:
D G < 0
В обратимом процессе совершается максимальная полезная работа за счет убыли энергии Гиббса:
D G = - W ′max
Из полученного выражения следует вывод:
Энергия Гиббса, это функция состояния системы, изменение которой равно максимальной полезной работе процесса.
Введем понятие стандартного изменения энергии Гиббса.
Стандартное изменение энергии Гиббса химической реакции, Dr G ° – это изменение энергии Гиббса при одном обороте реакции в системе, находящейся в стандартном состоянии (вспомните стандартное состояние: 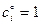 ). Отсюда следует, что Dr G изменяется по мере протекания реакции, так как изменяются концентрации, но подробно об этом – на следующей лекции.
). Отсюда следует, что Dr G изменяется по мере протекания реакции, так как изменяются концентрации, но подробно об этом – на следующей лекции.
Расчет Dr G ° производят по табличным значениям Df G ° веществ, участвующих в реакции, или по отдельности вычисляют Dr H ° и Dr S °, после чего применяют формулу для изменения энергии Гиббса.
Слагаемые Dr H и T Dr S рассматриваются в качестве энергетического и энтропийного факторов, определяющих возможность самопроизвольного протекания реакции в закрытой системе. Эти факторы независимо один от другого могут иметь как положительные, так и отрицательные значения.
| Способствует | Препятствует |
| Энергетический фактор D H | |
| D H < 0 | D H > 0 |
| Энтропийный фактор D S | |
| D S > 0 | D S < 0 |
Рассмотрим типичные случаи на примерах.
1. D H < 0, D S > 0. Тогда D G < 0 при всех температурах. Реакция идет самопроизвольно. В случае разложения озона
2О3 = 3О2, Dr H ° = -326 кДж, Δ S ° = 139 Дж/К
Энтропия заведомо возрастает, так как газа становится больше. Изменение энергии Гиббса отрицательно при всех значениях температуры. Обратная реакция самопроизвольно вообще не идет (но идет фотохимическая реакция образования озона в атмосфере).
2. D H < 0, D S < 0. D G окажется отрицательным при условии |D H | > T D S. Появляется возможность изменения направления реакции при повышении температуры.
2NO2(г) = N2О4(г), Dr H ° = -59,7 кДж, Dr S = -176,2 Дж/К, следовательно, Dr G ° = -7,2 кДж (это проверьте расчетом)
3. NaCl(кр) = NaCl (aq), Dr H ° = +3,8 кДж, Dr S = +43 Дж/К, Dr G ° = -9,02 кДж.
Остановимся подробнее, что мы выясняем, рассчитав значение D G ° растворения. То, что хлорид натрия растворяется в воде, и так понятно. Отрицательное значение D G ° показывает, что растворение происходит в растворе NaCl с концентрацией 1 моль/л. А могло бы и не происходить, если D G ° > 0. Очевидно, что растворимость больше 1 моль/л.

Термодинамическая устойчивость веществ. Это отсутствие у вещества таких превращений, у которых
Dr G < 0
Для глюкозы возможно превращение в молочную кислоту, спиртовое брожение и др. превращения с Dr G < 0. Она термодинамически неустойчива. У неорганических веществ возможностей для превращения меньше. Хлорид натрия мог бы только разложиться на натрий и хлор, но для такого процесса Dr G > 0. Эта соль устойчива.
Сопряжение реакций – средство осуществления не самопроизвольной реакции за счет самопроизвольной. Альфа и омега биоэнергетики.
Сопряженнными называются реакции, идущие через образование общей промежуточной частицы.
Δr G °


 Гл + Фр Сах + Н2О +21
Гл + Фр Сах + Н2О +21

 Гл-1-Ф + Фр + АДФ + Н2О
Гл-1-Ф + Фр + АДФ + Н2О
 АТФ + Н2О АДФ + Ф –30
АТФ + Н2О АДФ + Ф –30
Dr G ° = +21 - 30 = - 9 кДж/моль
Согласно схеме, общая промежуточная частица – это глюкоза-1-фосфат, то есть происходит фосфорилирование глюкозы. Суммарный процесс оказался самопроизвольным. При его протекании происходит передача потенциальной энергии на образование сахарозы. Это равнозначно совершению работы. Избыточная энергия 9 кДж/моль, освобождающаяся при сопряженном процессе, переходит в теплоту.
К схеме проведения процесса в обратимых и необратимых условиях:
С6Н12О6 = 2С3Н6О3; Dr H ° = -108 кДж;
Dr G ° = -161 кДж; DrS = +178 Дж/К
Необратимый процесс
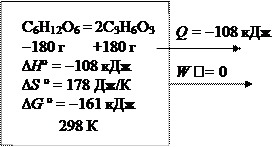 | |||
| |||
В необратимом процессе
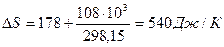
Обратимый процесс
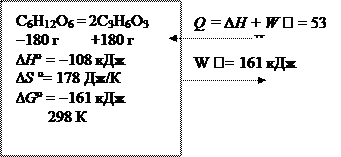 |
В обратимом процессе
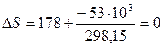 ,
,
что и следовало ожидать для обратимого процесса в изолированной системе, так как среда включена в систему.
При КПД 67% этот процесс пойдет без выделения и поглощения теплоты.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1071; Нарушение авторских прав?; Мы поможем в написании вашей работы!