
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Усредненный состав газов БГ и шахтного газа
|
|
|
|
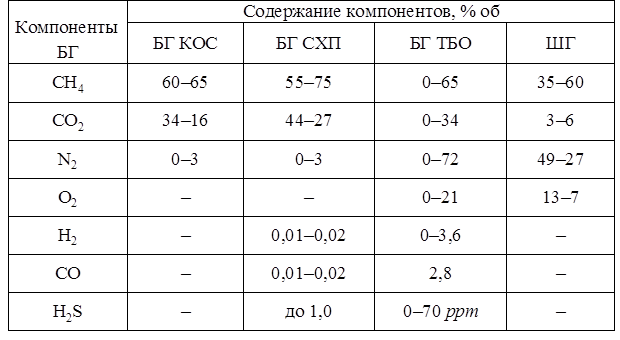
2. Физико-химические характеристики горючих газов
К основным показателям, характеризующим свойства горючих газов, как энергоносителей относятся: химическая формула, теплота сгорания, плотность, относительная плотность, число Воббе, пределы воспламеняемости, температура воспламенения, температура горения жаропроизводительность.
Таблица3
Основные характеристики горючих газов

 Химическая формула газа отражает элементный химический состав последнего и позволяет отчасти представить его химические и физические свойства. Так, углеводородные газы состоят из простых углеводородных соединений, являющихся органическими веществами, содержащими в своем составе два химических элемента: углерод С и водород Н2. Самый простой углеводород, содержащий всего один атом углерода, – метан СН4. Все углеводороды, имеют общую формулу – СmHn, входят в гомологический ряд так называемых предельных или насыщенных углеводородов – соединений, в которых углерод до предела насыщен атомами водорода. При температуре 0 °С и давлении 760 мм рт. ст. из предельных углеводородов газами являются лишь метан – СН4, этан – С2Н6, пропан – С3Н8 и бутан – С4Н10. Наряду с нормальными предельными углеводородами существуют так называемые изомерные соединения, имеющие одинаковые с первыми химические формулы, но отличающиеся от них характером расположения атомов углерода, а также некоторыми свойствами. Пропан изомера не имеет. Начиная с бутана, каждая суммарная формула алканов охватывает несколько углеводородов, имеющих одинаковые молекулярные массы, но разную структуру. Так формуле С4Н10 отвечают два бутана: СН3–СН2–СН5–СН3 нормальный бутан; СН3–СН–СН3–СН3 изобутан. Изомер бутана – изобутан. Для обозначения нормального бутана используют русскую строчную курсивную букву «н» и записывают н-бутан, а к химической формуле изобутана добавляют приставку изо (также курсивом) и записывают изо-С4Н10 либо i -С4H10. Кроме предельных и их изомеров в составе сжиженных углеводородов могут присутствовать ненасыщенные или непредельные углеводороды, характеризующиеся двойной или тройной связью между атомами углерода. Это этилен – С2Н4, пропилен – С3Н6, бутилен – C4H8 и изобутилен – i -C4H8. Непредельные углеводороды с называются олефинами, или алкенами. Топливные газы представляют собой смесь отдельных газов, но при рассмотрении теплотехнических характеристик этой смеси нужно учитывать, что ее компоненты не вступают в химические реакции друг с другом.
Химическая формула газа отражает элементный химический состав последнего и позволяет отчасти представить его химические и физические свойства. Так, углеводородные газы состоят из простых углеводородных соединений, являющихся органическими веществами, содержащими в своем составе два химических элемента: углерод С и водород Н2. Самый простой углеводород, содержащий всего один атом углерода, – метан СН4. Все углеводороды, имеют общую формулу – СmHn, входят в гомологический ряд так называемых предельных или насыщенных углеводородов – соединений, в которых углерод до предела насыщен атомами водорода. При температуре 0 °С и давлении 760 мм рт. ст. из предельных углеводородов газами являются лишь метан – СН4, этан – С2Н6, пропан – С3Н8 и бутан – С4Н10. Наряду с нормальными предельными углеводородами существуют так называемые изомерные соединения, имеющие одинаковые с первыми химические формулы, но отличающиеся от них характером расположения атомов углерода, а также некоторыми свойствами. Пропан изомера не имеет. Начиная с бутана, каждая суммарная формула алканов охватывает несколько углеводородов, имеющих одинаковые молекулярные массы, но разную структуру. Так формуле С4Н10 отвечают два бутана: СН3–СН2–СН5–СН3 нормальный бутан; СН3–СН–СН3–СН3 изобутан. Изомер бутана – изобутан. Для обозначения нормального бутана используют русскую строчную курсивную букву «н» и записывают н-бутан, а к химической формуле изобутана добавляют приставку изо (также курсивом) и записывают изо-С4Н10 либо i -С4H10. Кроме предельных и их изомеров в составе сжиженных углеводородов могут присутствовать ненасыщенные или непредельные углеводороды, характеризующиеся двойной или тройной связью между атомами углерода. Это этилен – С2Н4, пропилен – С3Н6, бутилен – C4H8 и изобутилен – i -C4H8. Непредельные углеводороды с называются олефинами, или алкенами. Топливные газы представляют собой смесь отдельных газов, но при рассмотрении теплотехнических характеристик этой смеси нужно учитывать, что ее компоненты не вступают в химические реакции друг с другом.
Масса т, физическая величина, являющаяся мерой инертности и тяготения вещества (жидкости, газа). Измеряется в килограммах (кг). Однако масса не является мерой количества вещества. Единицей количества вещества считается моль, который равен количеству вещества системы, содержащей столько же структурных элементов (атомов, молекул), сколько атомов содержится в углероде массой 0,012 кг. Массу одного моля (киломоля) М называют молярной массой.
Объем газов V измеряют в кубических метрах (м3). Вследствие того, что объем газов изменяется при нагревании, охлаждении и сжатии, за его единицу принимают 1 м3 газа при нормальных условиях. Если температура t или давление Р отличаются от нормальных, то объем газа при нормальных условиях V 0 определяется по формуле
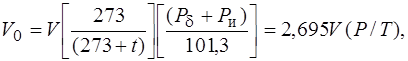
где V – объем газа, измеренный при рабочих условиях, м3; Р d – барометрическое давление, кПа, нормальное атмосферное давление Р d = 101,3 кПа; Р и – избыточное давление (измеренное манометром), кПа; Р – абсолютное давление, кПа, Р = Р d + Р и; t – температура, °С.
Основными точками для градуировки шкалы являются: температура плавления льда 0 °С и температура кипения воды 100 °С при нормальном атмосферном давлении 101,325 кПа; Т – абсолютная температура, К (абсолютная температура Т связана с температурой в градусах Цельсия t уравнением Т = t + 273 °С, абсолютный нуль температуры в градусах Цельсия равен – 273,15 °С).
Плотность газа – r характеризует его массу, приходящуюся на единицу объема (кг/м3). Известно, что плотность газов и их объем зависят от температуры. С повышением температуры объем газа в незамкнутых пространствах увеличивается, а в замкнутых возрастает его избыточное давление. В обоих случаях изменяется плотность газа. Для возможности сравнения свойств различных газов основные их характеристики должны быть приведены к одинаковым условиям. В технических расчетах это нормальные условия (Р = 760 мм рт. ст. t = 0 °С).
В финансовых же расчетах между поставщиками и потребителями газа применяют стандартные условия. В этом случае фактический объем газа, измеренный приборами учета при рабочем давлении и температуре, приводят с помощью специальных таблиц к объему при давлении 760 мм рт. ст. и температуре 20 °С. Плотность газа при нормальных условиях обозначается r0.
Зависимость изменения плотности при изменениях температуры и давления может быть выражена для газа однокомпонентного состава формулой
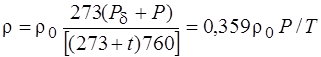 ,
,
где r – плотность газа при температуре отличной от 0 °С; r0 – плотность газа при температуре 0 °С и давлении 760 мм рт.ст.; Р – фактическое избыточное давление, мм рт. ст.; Р d – атмосферное (барометрическое) давление, мм рт. ст.; t – температура газа, °С; Р – абсолютное давление, мм рт. ст.; Т – абсолютная температура, К;
Плотность сложных газов при нормальных физических условиях может быть определена по формуле
rсм = 0,01(Sr i × ri),
rсм = 0,01(r1 r 1 + r2 r 2 +... + r nrn) = 0,01(0,72×СН4 + 1,35×С2Н6 +
+ 2,01×С3Н8 + 2,7×С4Н10 + 3,22×С5Н12 + 1,53×Н2S + 1,97×СО2 +
+ 1,25×N2) кг/м3;
ρ1, ρ 2,..., ρ n – плотность компонентов газа, кг/м3;
r 1, r 2,..., rn – содержание компонентов, %.
Удельный объем v – величина обратная плотности r, определяющая отношение объема газа (м3) к его массе (кг), измеряется в кубических метрах на килограмм (м3/кг).
Давление – физическая величина, характеризующая интенсивность нормальных (перпендикулярных к поверхности) сил, с которыми одно тело действует на поверхность другого. В газовой среде давление связано с передачей импульса при столкновениях находящихся в тепловом движении молекул газа друг с другом или с поверхностью граничащих с газом тел. В СИ единица измерения давления – паскаль (Па). Паскаль равен давлению, вызываемому силой 1Н (ньютон), равномерно распределенной по нормальной (вертикальной) к ней поверхности площадью 1 м2. Удобно использовать Па×10, т. е даПА так как давление выраженное в даПа равно величине давления выраженному в мм. рт. ст. На практике еще действующей единицей давления является техническая атмосфера (1 атм), равная в системе МКГСС давлению 1 кгс на поверхность 1 см2 (1 кгс/см2). Многие страны пользуются единицей давления – бар. Соотношения наиболее употребляемых в теплотехнике единиц, включая единицы давления, приводятся в табл. 4.
Для паров и газов различают избыточное P и, абсолютное P а и парциальное P п давление. Причем абсолютное давление включает в себя избыточное давление (измеренное манометром) и барометрическое (атмосферное давление на данный момент).
Поскольку топливные газы практически всегда являются смесями отдельных (идеальных) газов, не вступающих между собой в химические соединения, то каждый идеальный газ, входящий в смесь, распространяется по всему объему смеси и имеет свое давление, называемое парциальным. Согласно закону Дальтона общее давление смеси равно сумме давлений отдельных газов, образующих эту смесь
P a = P 1 + P2 +...+ Pn.
Таблица 4
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2247; Нарушение авторских прав?; Мы поможем в написании вашей работы!