
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Природный газ
|
|
|
|
Примеры расчета основных физико-химических свойств
CH4 – 93%
C2H6 – 3,1%
C3H8 – 0,7%
C4H10 – 0,6%
CO2 – 0,1%
N2 + редкие газы – 2,5%
Определение низшей теплоты сгорания
Q н = 0,01(∑ Q н i × C m H n),
где Q н i – низшая теплота сгорания отдельного компонента; C m H n – процентное содержание газа.
Q н = 0,01(35880×CH4 + 64360×C2H6 + 93180×C3H8 +
+ 123600×C4H10), кДж/м³
Q н = 0,01(35880×93 + 64360×3,1 + 93180×0,7 + 123500×0,6) =
= 36756,82 кДж/м³
Воздух состоит из:
О2» 21%
N2» 79%
Для 1м3 О2 требуется 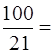 4,76 м³ воздуха.
4,76 м³ воздуха.
На 1м3 О2 приходится 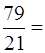 3,76 м³ N2
3,76 м³ N2
C m H n + (m +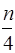 ) ( O2 +3,67N2) = m CO2+
) ( O2 +3,67N2) = m CO2+ 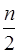 H2O + (m +
H2O + (m +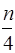 ) × 3,67 N2
) × 3,67 N2
Определение теоретического расхода сухого воздуха необходимого для полного сгорания 1м3 газа.
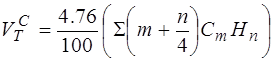 м3/м3
м3/м3
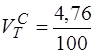 (2CH4 + 3,5C2H6 + 5C3H8 + 6,5C4H10) м3/м3
(2CH4 + 3,5C2H6 + 5C3H8 + 6,5C4H10) м3/м3
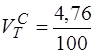 (2×93 + 3,5×3,1 + 5×0,7 + 6,5×0,6) = 9,7 м3/м3
(2×93 + 3,5×3,1 + 5×0,7 + 6,5×0,6) = 9,7 м3/м3
Определение теоретического расхода влажного воздуха необходимого для полного сгорания.
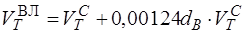 м3/м3
м3/м3
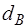 = 10гр – количество водяных паров в воздухе.
= 10гр – количество водяных паров в воздухе.
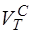 = 9,7 + 0,00124×10×9,7 = 9,8 м3/м3.
= 9,7 + 0,00124×10×9,7 = 9,8 м3/м3.
Действительный расход:
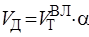 ,
,
где a = 1,05¸1,15,
принимаем a = 1,10, тогда
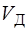 = 9,8 ×1,10 = 10,78 м3/м3.
= 9,8 ×1,10 = 10,78 м3/м3.
Определение плотности газа.
rсм = 0,01(Σρi×ri)
rсм = 0,01(0,72×93 + 1,35×3,1 + 2,01×0,7 + 2,7×0,6 + 1,977×0,1 +
+ 1,25×2,5) = 0,77 кг/м3
Определение относительной плотности газа:
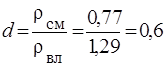 .
.
Определение давления при взрыве:
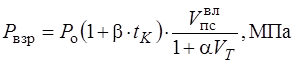
P o – атмосферное давление, Р о = 0,1МПа; t к – max температура, 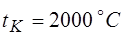 ;
; 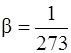 – коэффициент объемного расширения;
– коэффициент объемного расширения; 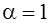 – коэффициент избытка воздуха, при котором происходит горение.
– коэффициент избытка воздуха, при котором происходит горение.
Объем продуктов сгорания влажный:
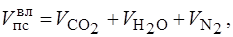 м3/м3
м3/м3
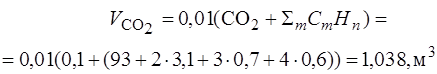
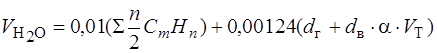 , м3/м3
, м3/м3
где 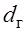 – влажность газа,
– влажность газа, 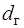 =10 гр.,
=10 гр., 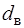 – влажность воздуха,
– влажность воздуха, 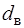 =10 гр.,
=10 гр.,
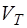 – теоретический расход воздуха;
– теоретический расход воздуха;
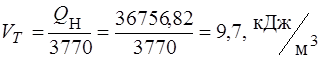
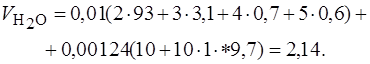
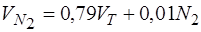
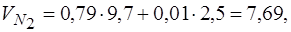 м3/м3
м3/м3
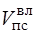 = 1,038 + 2,14 + 7,69 = 10,87, м3/м3
= 1,038 + 2,14 + 7,69 = 10,87, м3/м3
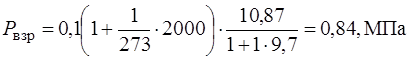
Пределы воспламеняемости (взрываемости):
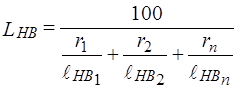 .
.
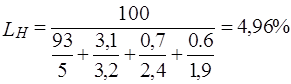 .
.
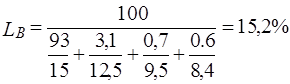 .
.
Определение верхнего и нижнего предела взрываемости газа содержащего балластные примеси – СО2 и N2:
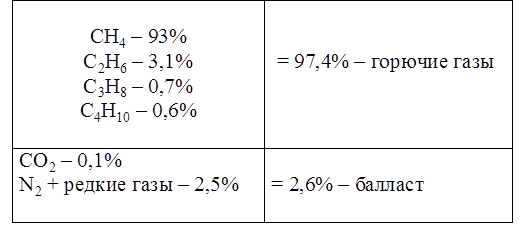
CH4 =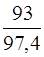 ×100 = 95,5 %
×100 = 95,5 %
C2H6 =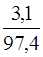 ×100 = 3,18 %
×100 = 3,18 %
C3H8 =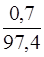 ×100 = 0,72 %
×100 = 0,72 %
C4H10 =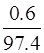 ×100 = 0,6 %
×100 = 0,6 %
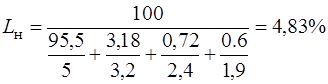
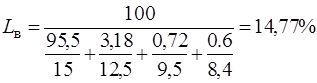
Нижний предел воспламеняемости с балластом:
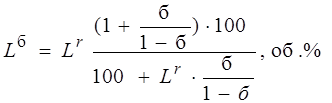
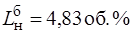
Определение времени загазованности:
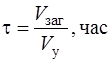
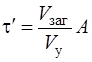 ,
,
где А – часовая кратность воздухообмена, принимаем двухкратный воздухообмен. А = 2.
V заг = V пом × L н,
где V пом – объем помещения (кухни)
V пом = 15 м3.
V заг = 15 × 0,0483 = 0,7245 м3.
V у = 0,2 м3/час
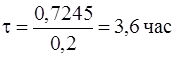
τ′ = τ А = 3,6× 2 = 7,2 час
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 440; Нарушение авторских прав?; Мы поможем в написании вашей работы!