
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вазопрессин и окситоцин
Гормоны вазопрессин и окситоцин синтезируются рибосомальным путем, причем одновременно в гипоталамусе синтезируются 3 белка: нейрофизин I, II и III, функция которых заключается в нековалентном связывании окситоцина и вазопрессина и транспорте этих гормонов в нейросекреторные гранулы гипоталамуса. Далее в виде комплексов нейрофизин–гормон они мигрируют вдоль аксона и достигают задней доли гипофиза, где откладываются про запас; после диссоциации комплекса свободный гормонсекретируется в кровь. Нейрофизины также выделены в чистом виде, и выяснена первичная структура двух из них (92 из 97 аминокислотных остатков соответственно); это богатые цистеином белки, содержащие по семь дисульфидных связей.
Химическое строение обоих гормонов было расшифровано классическими работами В. дю Виньо и сотр., впервые выделивших эти гормоны из задней доли гипофиза и осуществивших их химический синтез. Оба гормона представляют собой нонапептиды следующего строения:
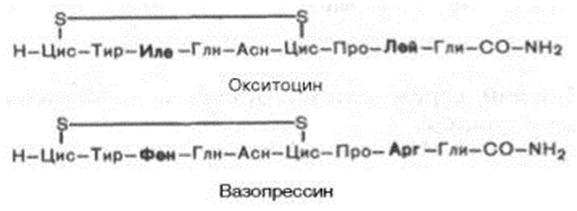
Вазопрессин отличается от окситоцина двумя аминокислотами: он содержит в положении 3 от N-концафенилаланин вместо изолейцина и в положении 8 – аргинин вместо лейцина. Указанная последовательность 9 аминокислот характерна для вазопрессина человека, обезьяны, лошади, крупного рогатого скота, овцы и собаки. В молекуле вазопрессина из гипофиза свиньи вместо аргинина в положении 8 содержится лизин, отсюда название «лизин-вазопрессин». У всех позвоночных, за исключением млекопитающих, идентифицирован, кроме того, вазотоцин. Этот гормон, состоящий из кольца с S—S мостиком окситоцина и боковой цепью вазопрессина, был синтезирован химически В. дю Виньо задолго до выделения природного гормона. Высказано предположение, что эволю-ционно все нейрогипофизарныегормоны произошли от одного общего предшественника, а именно аргинин-вазотоцина, из которого путем одиночных мутаций триплетов генов образовались модифицированные гормоны.
Основной биологический эффект окситоцина у млекопитающих связан со стимуляцией сокращения гладких мышц матки при родах и мышечных волокон вокруг альвеол молочных желез, что вызывает секрециюмолока. Вазопрессин стимулирует сокращение гладких мышечных волокон сосудов, оказывая сильное вазопрессорное действие, однако основная роль его в организме сводится к регуляции водного обмена, откуда его второе название антидиуретического гормона. В небольших концентрациях (0,2 нг на 1 кг массы тела) вазопрессин оказывает мощное антидиуретическое действие – стимулирует обратный ток воды черезмембраны почечных канальцев. В норме он контролирует осмотическое давление плазмы крови и водный баланс организма человека. При патологии, в частности атрофии задней доли гипофиза, развивается несахарный диабет – заболевание, характеризующееся выделением чрезвычайно больших количествжидкости с мочой. При этом нарушен обратный процесс всасывания воды в канальцах почек.
Относительно механизма действия нейрогипофизарных гормонов известно, что гормональные эффекты, в частности вазопрессина, реализуются
через аденилатциклазную систему (см. далее). Однако конкретный механизм действия вазопрессина на транспорт воды в почках пока остается неясным.
Меланоцитстимулирующие гормоны (МСГ, меланотропины)
Меланотропины синтезируются и секретируются в кровь промежуточной долей гипофиза. Выделены и расшифрованы первичные структуры двух типов гормонов – α- и β-меланоцитстимулирующие гормоны (α-МСГ и β-МСГ). Оказалось, что у всех обследованных животных α-МСГ состоит из 13 остатков аминокислот, расположенных в одинаковой последовательности:
СН3-СО-NH-Сер–Тир–Сер–Мет–Глу–Гис–Фен–Арг–Трп–Гли–Лиз–
–Про–Вал-СО-NН2
В α-МСГ N-концевой серин ацетилирован, а С-концевая аминокислота представлена валинамидом.
Состав и структура β-МСГ оказались более сложными. У большинства животных молекула β-МСГ состоит из 18 остатков аминокислот; кроме того, имеются видовые различия, касающиеся природы аминокислоты в положениях 2, 6 и 16 полипептидной цепи гормона. β-МСГ, выделенный из промежуточной доли гипофизачеловека, оказался 22-членным пептидом, удлиненным на 4 аминокислотных остатка с N-конца:
Н-Ала–Глу–Лиз–Лиз–Асп–Глу–Гли–Про–Тир–Aрг–Мет–Глу–Гис–Фен– –Арг–Трп–Гли–Сер–Про–Про–Лиз–Асп-ОН
Физиологическая роль меланотропинов заключается в стимулировании меланиногенеза у млекопитающих и увеличении количества пигментных клеток (меланоцитов) в кожных покровах земноводных. Возможно также влияние МСГ на окраску меха и секреторную функцию сальных желез у животных.
Адренокортикотропный гормон (АКТГ, кортикотропин)
Еще в 1926 г. было установлено, что гипофиз оказывает стимулирующее влияние на надпочечники, повышаясекрецию гормонов коркового вещества. Накопленные к настоящему времени данные свидетельствуют, что этим свойством наделен АКТГ, вырабатываемый базофильными клетками аденогипофиза. АКТГ, помимо основного действия – стимуляции синтеза и секреции гормонов коры надпочечников, обладает жиромобилизующей и меланоцитстимулирующей активностью.
Молекула АКТГ у всех видов животных содержит 39 аминокислотных остатков. Первичная структура АКТГсвиньи и овцы была расшифрована еще в 1954–1955 гг. Приводим уточненное строение АКТГ человека:
Н-Сер–Тир–Сер–Мет–Глу–Гис–Фен–Арг–Трп–Гли–Лиз–Про–Вал–Гли–
–Лиз–Лиз–Aрг–Aрг–Про–Вал–Лиз–Вал–Тир–Про–Асп–Ала–Гли–Глу–
–Асп–Глн–Сер–Ала–Глу–Ала–Фен–Про–Лей–Глу–Фен-ОН
Различия в структуре АКТГ овцы, свиньи и быка касаются только природы 31-го и 33-го остатковаминокислот, однако все они наделены почти одинаковой биологической активностью, как и АКТГ гипофизачеловека. В молекуле АКТГ, как и других белковых гормонов, хотя и не открыты активные центры наподобиеактивных центров ферментов, однако предполагается наличие двух активных участков пептидной цепи, один из которых ответствен за связывание с соответствующим рецептором, другой – за гормональный эффект.
Данные о механизме действия АКТГ на синтез стероидных гормонов свидетельствуют о существенной роли аденилатциклазной системы. Предполагают, что АКТГ вступает во взаимодействие со специфическимирецепторами на внешней поверхности клеточной мембраны (рецепторы представлены белками в комплексе с другими молекулами, в частности с сиаловой кислотой). Сигнал затем передается на ферментаденилатцикла-зу, расположенную на внутренней поверхности клеточной мембраны, которая катализирует распад АТФ и образование цАМФ. Последний активирует протеинкиназу, которая в свою очередь с участиемАТФ осуществляет фосфорилирование холинэстеразы, превращающей эфиры холестерина в свободныйхолестерин, который поступает в митохондрии надпочечников, где содержатся все ферменты, катализирующие превращение холестерина в кортикостероиды.
Соматотропный гормон (СТГ, гормон роста, соматотропин)
Гормон роста был открыт в экстрактах передней доли гипофиза еще в 1921 г., однако в химически чистом виде получен только в 1956–1957 гг. СТГ синтезируется в ацидофильных клетках передней доли гипофиза;концентрация его в гипофизе составляет 5–15 мг на 1 г ткани, что в 1000 раз превышает концентрациюдругих гормонов гипофиза. К настоящему времени полностью выяснена первичная структура белковоймолекулы СТГ человека, быка и овцы. СТГ человека состоит из 191 аминокислоты и содержит дведисульфидные связи; N- и С-концевые аминокислоты представлены фенилаланином.
СТГ обладает широким спектром биологического действия. Он влияет на все клетки организма, определяя интенсивность обмена углеводов, белков, липидов и минеральных веществ. Он усиливает биосинтез белка,ДНК, РНК и гликогена и в то же время способствует мобилизации жиров из депо и распаду высших жирных кислот и глюкозы в тканях. Помимо активации процессов ассимиляции, сопровождающихся увеличением размеров тела, ростом скелета, СТГ координирует и регулирует скорость протекания обменных процессов. Кроме того, СТГ человека и приматов (но не других животных) обладает измеримой лактогеннойактивностью. Предполагают, что многие биологические эффекты этого гормона осуществляются через особый белковый фактор, образующийся в печени под влиянием гормона. Этот фактор был назван сульфирующим или тимидиловым, поскольку он стимулирует включение сульфата в хрящи, тимидина – вДНК, уридина – в РНК и пролина – в коллаген. По своей природе этот фактор оказался пептидом с мол. массой 8000. Учитывая его биологическую роль, ему дали наименование «соматомедин», т.е. медиатордействия СТГ в организме.
СТГ регулирует процессы роста и развития всего организма, что подтверждается клиническими наблюдениями. Так, при гипофизарной карликовости (патология, известная в литературе как пангипопитуитаризм; связана с врожденным недоразвитием гипофиза) отмечается пропорциональное недоразвитие всего тела, в том числе скелета, хотя существенных отклонений в развитии психической деятельности не наблюдается. У взрослого человека также развивается ряд нарушений, связанных с гипо- или гиперфункцией гипофиза. Известно заболевание акромегалия (от греч. akros – конечность, megas – большой), характеризующееся непропорционально интенсивным ростом отдельных частей тела, например рук, ног, подбородка, надбровных дуг, носа, языка, и разрастанием внутренних органов. Болезнь вызвана, по-видимому, опухолевым поражением передней доли гипофиза.
Лактотропный гормон (пролактин, лютеотропный гормон)
Пролактин считается одним из наиболее «древних» гормонов гипофиза, поскольку его удается обнаружить вгипофизе низших наземных животных, у которых отсутствуют молочные железы, а также получить лактогенный эффект у млекопитающих. Помимо основного действия (стимуляция развития молочных желези лактации), пролактин имеет важное биологическое значение – стимулирует рост внутренних органов,секрецию желтого тела (отсюда его второе название «лютеотропный гормон»), оказывает рено-тропное, эритропоэтическое и гипергликемическое действие и др. Избыток пролактина, образующийся обычно при наличии опухолей из секретирую-щих пролактин клеток, приводит к прекращению менструаций (аменорея) и увеличению молочных желез у женщин и к импотенции – у мужчин.
Расшифрована структура пролактина из гипофиза овцы, быка и человека. Это крупный белок, представленный одной полипептидной цепью с тремя дисульфидными связями, состоящий из 199 аминокислотных остатков. Видовые отличия в последовательности аминокислот касаются по существу 2–3 аминокислотных остатков. Раньше оспаривалось мнение о секреции лактотропина в гипофизе человека, поскольку предполагали, что его функцию якобы выполняет соматотропин. В настоящее время получены убедительные доказательства существования пролактина человека, хотя в гипофизе его содержится значительно меньше, чем гормона роста. В крови женщин уровень пролактина резко повышается перед родами: до 0,2 нг/л против 0,01 нг/л в норме.
Тиреотропный гормон (ТТГ, тиротропин)
В отличие от рассмотренных пептидных гормонов гипофиза, представленных в основном одной полипептидной цепью, тиротропин является сложным гликопротеином и содержит, кроме того, по две α- и β-субъединицы, которые в отдельности биологической активностью не обладают: мол. масса его около 30000.
Тиротропин контролирует развитие и функцию щитовидной железы и регулирует биосинтез и секрецию вкровь тиреоидных гормонов. Полностью расшифрована первичная структура α- и β-субъединиц тиротропина быка, овцы и человека: α-субъединица, содержащая 96 аминокислотных остатков, имеет одинаковуюаминокислотную последовательность во всех изученных ТТГ и во всех лютеинизирующих гормонах гипофиза; β-субъеди-ница тиротропина человека, содержащая 112 аминокислотных остатков, отличается от аналогичного полипептида в ТТГ крупного рогатого скота аминокислотными остатками и отсутствием С-концевого метионина. Поэтому многие авторы специфические биологические и иммунологические свойствагормона объясняют наличием β-субъединицы ТТГ в комплексе с α-субъединицей. Предполагают, что действие тиротропина осуществляется, подобно действию других гормонов белковой природы, посредством связывания со специфическими рецепторами плазматических мембран и активирования аденилатциклазной системы (см. далее).
Липотропные гормоны (ЛТГ, липотропины)
Среди гормонов передней доли гипофиза, структура и функция которых выяснены в последнее десятилетие, следует отметить липотропины, в частности β- и γ-ЛТГ. Наиболее подробно изучена первичная структура β-липо-тропина овцы и свиньи, молекулы которого состоят из 91 аминокислотного остатка и имеют существенные видовые различия в последовательности аминокислот. К биологическим свойствам β-липотропина относятся жиро-мобилизующее действие, кортикотропная, меланоцитстимулирующая и ги-покальциемическая активность и, кроме того, инсулиноподобный эффект, выражающийся в повышении скорости утилизации глюкозы в тканях. Предполагают, что липотропный эффект осуществляется через систему аденилатциклаза–цАМФ–протеинкиназа, завершающей стадией действия которой являетсяфосфорилирование неактивной триацилглицерол-липазы. Этот фермент после активирования расщепляетнейтральные жиры на диацилглицерол и высшую жирную кислоту (см. главу 11).
Перечисленные биологические свойства обусловлены не β-липотропи-ном, оказавшимся лишенным гормональной активности, а продуктами его распада, образующимися при ограниченном протеолизе. Оказалось, что в ткани мозга и в промежуточной доле гипофиза синтезируются биологически активныепептиды, наделенные опиатоподобным действием. Приводим структуры некоторых из них:
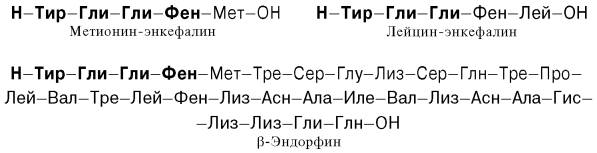
Общим типом структуры для всех трех соединений является тетра-пептидная последовательность на N-конце. Доказано, что β-эндорфин (31 АМК) образуется путем протеолиза из более крупного гипофизарногогормона β-липотропина (91 АМК); последний вместе с АКТГ образуется из общего предшественника – прогормона, названного проопиокортином (является, таким образом, препрогормоном), имеющиммолекулярную массу 29 кДа и насчитывающим 134 аминокислотных остатка. Биосинтез и освобождение проопиокортина в передней доле гипофиза регулируется кортиколиберином гипоталамуса. В свою очередь из АКТГ и β-липо-тропина путем дальнейшего процессинга, в частности ограниченного про-теолиза, образуются соответственно α- и β-меланоцитстимулирующие гормоны (α- и β-МСГ). С помощью техникиклонирования ДНК, а также метода определения первичной структуры нуклеиновых кислот Сенджера в ряде лабораторий была раскрыта нуклеотидная последовательность мРНК–предшественника проопиокортина. Эти исследования могут служить основой для целенаправленного получения новых биологически активных гормональных лечебных препаратов.
Ниже представлены пептидные гормоны, образующиеся из β-липотро-пина путем специфическогопротеолиза.

Учитывая исключительную роль β-липотропина как предшественника перечисленных гормонов, приводим первичную структуру β-липотропина свиньи (91 аминокислотный остаток):
Н–Глу–Лей–Ала–Гли–Ала–Про–Про–Глу–Про–Ала–Aрг–Асп–Про–Глу– –Ала–Про–Ала–Глу–Гли–Ала–Ала–Ала–Aрг–Ала–Глу–Лей–Глу–Тир– –Гли–Лей–Вал–Ала–Глу–Ала–Глу–Ала–Ала–Глу–Лиз–Лиз–Асп–Глу– –Гли–Про–Тир–Лиз–Мет–Глу–Гис–Фен–Арг–Трп–Гли–Сер–Про–Про– –Лиз–Асп–Лиз–Aрг–Тир–Гли–Гли–Фен–Мет–Тре–Сер–Глу–Лиз–Сер– –Глн–Тре–Про–Лей–Вал–Тре–Лей–Фен–Лиз–Асн–Ала–Иле–Вал–Лиз– –Асн–Ала–Гис–Лиз–Лиз–Гли–Глн–ОН
Повышенный интерес к указанным пептидам, в частности энкефалинам и эндорфинам, диктуется их необычайной способностью, подобно морфину, снимать болевые ощущения. Эта область исследования – поиск новых природных пептидных гормонов и(или) их направленный биосинтез – является интересной и многообещающей для развития физиологии, нейробиологии, неврологии и клиники.
ГОРМОНЫ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ (ПАРАТГОРМОНЫ)
К гормонам белковой природы относится также паратиреоидный гормон (паратгормон), точнее, группапаратгормонов, различающихся последовательностью аминокислот. Они синтезируются паращитовиднымижелезами. Еще в 1909 г. было показано, что удаление паращитовидных желез вызывает у животных тетанические судороги на фоне резкого падения концентрации кальция в плазме крови; введение солейкальция предотвращало гибель животных. Однако только в 1925 г. из паращитовидных желез был выделен активный экстракт, вызывающий гормональный эффект – повышение содержания кальция в крови. Чистыйгормон был получен в 1970 г. из паращитовидных желез крупного рогатого скота; тогда же была определена его первичная структура. Выяснено, что паратгормон синтезируется в виде предшественника (115 аминокислотных остатков) пропарат-гормона, однако первичным продуктом гена оказался препропарат-гормон, содержащий дополнительно сигнальную последовательность из 25 аминокислотных остатков.Молекула паратгормона быка содержит 84 аминокислотных остатка и состоит из одной полипептидной цепи.
Выяснено, что паратгормон участвует в регуляции концентрации катионов кальция и связанных с нимианионов фосфорной кислоты в крови. Как известно, концентрация кальция в сыворотке крови относится к химическим константам, суточные колебания ее не превышают 3–5% (в норме 2,2– 2,6 ммоль/л). Биологически активной формой считается ионизированный кальций, концентрация его колеблется в пределах 1,1–1,3 ммоль/л. Ионы кальция оказались эссенциальными факторами, не заменимыми другимикатионами для ряда жизненно важных физиологических процессов: мышечное сокращение, нервно-мышечное возбуждение, свертывание крови, проницаемость клеточных мембран, активность рядаферментов и т.д. Поэтому любые измененния этих процессов, обусловленные длительным недостаткомкальция в пище или нарушением его всасывания в кишечнике, приводят к усилению синтеза паратгормона, который способствует вымыванию солей кальция (в виде цитратов и фосфатов) из костной ткани и соответственно к деструкции минеральных и органических компонентов костей.
Другой орган-мишень паратгормона – это почка. Паратгормон уменьшает реабсорбцию фосфата вдистальных канальцах почки и повышает канальце-вую реабсорбцию кальция.
Следует указать, что в регуляции концентрации Са2+ во внеклеточной жидкости основную роль играют тригормона: паратгормон, кальцитонин, синтезируемый в щитовидной железе (см. далее), и кальцитриол [1,25(ОН)2-D3] – производное D3(см. главу 7). Все три гормона регулируют уровень Са2+, но механизмы их действия различны. Так, главная роль кальцитрио-ла заключается в стимулировании всасывания Са2+ ифосфата в кишечнике, причем против концентрационного градиента, в то время как паратгормонспособствует выходу их из костной ткани в кровь, всасыванию кальция в почках и выделению фосфатов смочой. Менее изучена роль кальцитонина в регуляции гомеостаза Са2+ в организме. Следует отметить также, что кальцитриол по механизму действия на клеточном уровне аналогичен действию стероидных гормонов (см. ниже).
Считается доказанным, что физиологическое влияние паратгормона на клетки почек и костной тканиреализуется через систему аденилатциклаза-цАМФ (см. далее).
|
|
Дата добавления: 2014-01-03; Просмотров: 2452; Нарушение авторских прав?; Мы поможем в написании вашей работы!