
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Инсулин. Гормоны поджелудочной железы
|
|
|
|
ГОРМОНЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Поджелудочная железа относится к железам со смешанной секрецией. Внешнесекреторная функция ее заключается в синтезе ряда ключевых ферментов пищеварения, в частности амилазы, липазы, трипсина, химо-трипсина, карбоксипептидазы и др., поступающих в кишечник с соком поджелудочной железы. Внутрисекреторную функцию выполняют, как было установлено в 1902 г. Л.В. Соболевым, панкреатические островки (островки Лангерганса), состоящие из клеток разного типа и вырабатывающие гормоны, как правило, противоположного действия. Так, α- (или А-) клетки продуцируют глюкагон, β- (или В-) клеткисинтезируют инсулин, δ-(или D-) клетки вырабатывают соматостатин и F-клетки – малоизученный панкреатический полипептид. Далее будут рассмотрены инсулин и глюка-гон как гормоны, имеющие исключительно важное значение для жизнедеятельности организма.
Инсулин, получивший свое название от наименования панкреатических островков (лат. insula – островок), был первым белком, первичная структура которого была раскрыта в 1954 г. Ф. Сэнджером (см. главу 1). В чистом виде инсулин был получен в 1922 г. после его обнаружения в экстрактах панкреатических островков Ф. Бантингом и Ч. Бестом. Молекула инсулина, содержащая 51 аминокислотный остаток, состоит из двух полипептидных цепей, соединенных между собой в двух точках дисульфидными мостиками. Строениеинсулина и его предшественника проинсулина приведено в главе 1 (см. рис. 1.14). В настоящее время принято обозначать цепью А инсулина 21-членный пептид и цепью В – пептид, содержащий 30 остатковаминокислот. Во многих лабораториях осуществлен, кроме того, химический синтез инсулина. Наиболее близким по своей структуре к инсулину человека является инсулин свиньи, у которого в цепи В вместотреонина в положении 30 содержится аланин.
Существенных различий в аминокислотной последовательности в инсулине от разных животных нет.Инсулины различаются аминокислотным составом цепи А в положениях 8–10.
Согласно современным представлениям, биосинтез инсулина осуществляется в β-клетках панкреатических островков из своего предшественника проинсулина, впервые выделенного Д. Стайнером в 1966 г. В настоящее время не только выяснена первичная структура проинсулина, но и осуществлен его химический синтез (см. рис. 1.14). Проинсулин представлен одной полипептидной цепью, содержащей 84 аминокислотных остатка; он лишен биологической, т.е. гормональной, активности. Местом синтеза проинсули-на считается фракция микросом β-клеток панкреатических островков; превращение неактивного проинсулина в активный инсулин (наиболее существенная часть синтеза) происходит при перемещении проинсулина от рибосом к секреторным гранулам путем частичного протеолиза (отщепление с С-конца полипептидной цепи пептида, содержащего 33 аминокислотных остатка и получившего наименование соединяющего пептида, или С-пепти-да). Длина и первичная структура С-пептида подвержена большим изменениям у разных видов животных, чем последовательность цепей А и В инсулина. Установлено, что исходным предшественником инсулина является препроинсулин, содержащий, помимо проинсулина, его так называемую лидерную, или сигнальную, последовательность на N-конце, состоящую из 23 остатковаминокислот; при образовании молекулы проинсулина этот сигнальный пептид отщепляется специальнойпептидазой. Далее молекула проинсулина также подвергается частичному протеолизу, и под действием трипсиноподобной протеиназы отщепляются по две основные аминокислоты с N- и С-конца пептида С – соответственно дипептиды Aрг–Aрг и Лиз– –Aрг (см. рис. 1.14). Однако природа ферментов и тонкие механизмы этого важного биологического процесса – образование активной молекулы инсулинаокончательно не выяснены.
Синтезированный из проинсулина инсулин может существовать в нескольких формах, различающихся по биологическим, иммунологическим и физико-химическим свойствам. Различают две формы инсулина: 1) свободную, вступающую во взаимодействие с антителами, полученными к кристаллическому инсулину, и стимулирующую усвоение глюкозы мышечной и жировой тканями; 2) связанную, не реагирующую сантителами и активную только в отношении жировой ткани. В настоящее время доказано существование связанной формы инсулина и установлена локализация ее в белковых фракциях сыворотки крови, в частности в области трансферринов и α-глобулинов. Молекулярная масса связанного инсулина от 60000 до 100000. Различают, кроме того, так называемую форму А инсулина, отличающуюся от двух предыдущих рядом физико-химических и биологических свойств, занимающую промежуточное положение и появляющуюся в ответ на быструю, срочную потребность организма в инсулине.
В физиологической регуляции синтеза инсулина доминирующую роль играет концентрация глюкозы в крови. Так, повышение содержания глюкозы в крови вызывает увеличение секреции инсулина в панкреатических островках, а снижение ее содержания, наоборот,– замедление секреции инсулина. Этот феномен контроля по типу обратной связи рассматривается как один из важнейших механизмов регуляции содержания глюкозы в крови. На секрецию инсулина оказывают влияние, кроме того, электролиты(особенно ионы кальция), аминокислоты, глюкагон и секретин. Приводятся доказательства роли циклазной системы в секреции инсулина. Предполагают, что глюкоза действует в качестве сигнала для активирования аденилат-циклазы, а образовавшийся в этой системе цАМФ – в качестве сигнала для секреции инсулина.
При недостаточной секреции (точнее, недостаточном синтезе) инсулина развивается специфическое заболевание – сахарный диабет (см. главу 10). Помимо клинически выявляемых симптомов (полиурия, полидипсия и полифагия), сахарный диабет характеризуется рядом специфических нарушений процессов обмена. Так, у больных развиваются гипергликемия (увеличение уровня глюкозы в крови) и гликозурия (выделение глюкозы смочой, в которой в норме она отсутствует). К расстройствам обмена относят также усиленный распад гликогена в печени и мышцах, замедлениебиосинтеза белков и жиров, снижение скорости окисления глюкозы в тканях, развитие отрицательного азотистого баланса, увеличение содержанияхолестерина и других липидов в крови. При диабете усиливаются мобилизация жиров из депо, синтез углеводов из аминокислот (глюконеогенез) и избыточный синтез кетоновых тел (кетонурия). После введения больным инсулина все перечисленные нарушения, как правило, исчезают, однако действие гормона ограничено во времени, поэтому необходимо вводить его постоянно. Клинические симптомы и метаболические нарушения присахарном диабете могут быть объяснены не только отсутствием синтеза инсулина. Получены доказательства, что при второй форме сахарного диабета, так называемой инсулинрезистентной, имеют место и молекулярные дефекты: в частности, нарушение структуры инсулина или нарушение ферментативного превращения проинсулина в инсулин. В основе развития этой формы диабета часто лежит потеря рецепторами клеток-мишеней способности соединяться с молекулой инсулина, синтез которого нарушен, или синтез мутантного рецептора (см. далее).
У экспериментальных животных введение инсулина вызывает гипогликемию (снижение уровня глюкозы в крови), увеличение запасов гликогена в мышцах, усиление анаболических процессов, повышение скорости утилизации глюкозы в тканях. Кроме того, инсулин оказывает опосредованное влияние на водный и минеральный обмен.
Механизм действия инсулина окончательно не расшифрован, несмотря на огромное количество фактических данных, свидетельствующих о существовании тесной и прямой зависимости между инсулином и процессами обмена веществ в организме. В соответствии с «унитарной» теорией все эффекты инсулина вызваны его влиянием на обмен глюкозы через фермент гексокиназу. Новые экспериментальные данные свидетельствуют, что усиление и стимуляция инсулином таких процессов, как транспорт ионов и аминокислот, трансляция и синтез белка, экспрессия генов и др., являются независимыми. Это послужило основанием для предположения о множественных механизмах действия инсулина.
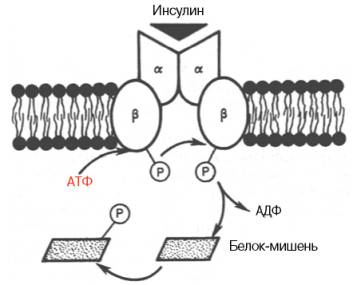
Рис. 8.1. Инсулиновый рецептор (схема). Две α-цепи на наружной поверхности мембраны клетки и две трансмембранные β-цепи. Связываниеинсулина с α-цепями запускает аутофосфорилирование остатков тирозина в β-цепях; активный тирозинкиназный домен затем участвует вфосфорилировании неактивных белков-мишеней в цитозоле.
Наиболее вероятной в настоящее время представляется мембранная локализация первичного действия почти всех белковых гормонов, включаяинсулин. Получены доказательства существования специфического рецептора инсулина на внешней плазматической мембране почти всех клетокорганизма, а также образования инсулинрецепторного комплекса. Рецептор синтезируется в виде предшественника – полипептида (1382 аминокислотных остатка, мол. масса 190000), который далее расщепляется на α-и β-субъединицы, т.е. на гетеродимер (в формуле α2–β2), связанные дисульфидными связями. Оказалось, что если α-субъединицы (мол. масса 135000) почти целиком располагаются на внешней стороне биомембраны, выполняя функцию связывания инсулина клетки, то β-субъединицы (мол. масса 95000) представляют собой трансмембранный белок, выполняющий функцию преобразования сигнала (рис. 8.1). Концентрация рецепторов инсулина на поверхности достигает 20000 на клетку, и период их полужизни составляет 7–12 ч.
Самым интересным свойством рецептора инсулина, отличным от всех других рецепторов гормонов белковой и пептидной природы, является его способность аутофосфорилирования, т.е. когда рецептор наделен сам протеинкиназной (тирозинкиназной) активностью. При связывании инсулина сα-цепями рецептора происходит активирование тирозинкиназной активности β-цепей путем фосфорилирования их тирозиновых остатков. В свою очередь активная тирозинкиназа β-цепей запускает каскад фосфо-рилирования–дефосфорилирования протеинкиназ, в частности мембранных или цитозольных серин- или треонинкиназ, т.е. протеинкиназ и белков-мишеней, фосфорилирование в которых осуществляется за счет ОН-групп серинаи треонина. Соответственно имеют место изменения клеточной активности, в частности активация и ингибирование ферментов, транспорт глюкозы, синтез полимерных молекул нуклеиновых кислот и белков и т.д. Следует подчеркнуть, однако, что тонкие молекулярные механизмы путей передачи сигнала от инсулинрецепторного комплекса на множество внутриклеточных процессов пока не раскрыты. Вполне возможно участие в подобных процессах ряда внутриклеточных вторичных мессенджеров, в частности циклических нуклеотидов, производных фосфатидилинозитолов и др. Нельзя исключить, кроме того, возможности существования внутриклеточного посредника или медиатора действия инсулина (особого внутриклеточногорецептора), контролирующего транскрипцию генов и соответственно синтез мРНК. Предполагают, что действием инсулина и участием в регуляцииэкспрессии генов или в транскрипции специфических мРНК может быть объяснена его роль в таких фундаментальных процессах жизнедеятельности, как эмбриогенез и дифференцировка клеток высших организмов.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 322; Нарушение авторских прав?; Мы поможем в написании вашей работы!