
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства солей
|
|
|
|
Названия солей.
| Кислотный остаток (анион) | Название соли |
| Cl- | хлорид |
| F- | фторид |
| NO3- | нитрат |
Если металл имеет переменную валентность, то она указывается после химического элемента римской цифрой, заключённой в скобки. Например CuSO4- сульфат меди (II).
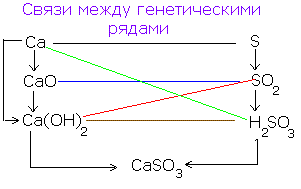
| Разложение при прокаливании | CaCO3=CaO+CO2 
|
| Cоль+металл | Fe+CuSO4=FeSO4+Cu |
| Соль+соль | AgNO3+NaCl=AgCl  +NaNO3 +NaNO3
|
| Соль+щелочь | CuSO4+2NaOH=Cu(OH)2  +Na2SO4 +Na2SO4
|
| Соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2 
|
Задание №2. Начертить электронные схемы строения ионов Na+, Ca2+, Fe3+.
Условия выполнения задания:
Задание №2. Начертить электронные схемы строения ионов Na+, Ca2+, Fe3+.
Na+ +11))
2 8
Ca2+ +20)))
2 8 8
Fe3+ ++26))))
2 8 11 2
Задание №1. Виды дисперсных систем. Классификация растворов.
Задание №2. Указать особенности электронного строения атомов меди (№ 28), хрома (№ 24).
Задание №1. Ответить на поставленный вопрос.
Виды дисперсных систем
Дисперсная система - это система, когда одно вещество мелко раздроблено в другом веществе.
Дисперсная фаза - это раздробленное вещество.
Дисперсионная среда - вещество, в котором распределена дисперсная фаза.
По агрегатному состоянию различают:
– газовые системы (воздух);
– твердые системы (сплавы металлов);
– жидкие (дисперсионная среда - вода, бензол, этиловый спирт).
Твердая или жидкая гомогенная система состоящая из 2-х или более компонентов называется раствором.
Растворенное вещество равномерно распределено в виде молекул, атомов или ионов в другом - растворителе.
В зависимости от размера растворенных частиц выделяют:
1. Грубодисперсные системы:
– суспензии - дисперсная фаза твердая (раствор глины);
– эмульсии - дисперсная фаза жидкая (молоко).
2. Коллоидные растворы (золи) - состоят из частиц очень малого размера (10-5 - 10-7 см), равномерно распределенных в какой-либо среде:
– в воде (гидрозоли),
– в органической жидкости (органозоли),
– в воздухе или другом газе (аэрозоли).
Золи занимают промежуточное положение между истинными растворами и грубодисперсными системами.
3. Истинные растворы - растворы, в которых частицы не могут быть обнаружены оптическим путем.
Диаметр дисперсных частиц в И.р. меньше 10 -7 см.
Жидкие растворы состоят из растворенного вещества, растворителя и продуктов их взаимодействия.
Задание №2. Указать особенности электронного строения атомов меди (№ 28), хрома (№ 24).

Энергетические диаграммы валентных подуровней атомов хрома и меди.
У атома хрома на 4 s -подуровне не два, как этого следовало бы ожидать, а только один электрон. Зато на 3 d -подуровне пять электронов, а ведь этот подуровень заполняется после 4 s -подуровня. Каждое из пяти 3 d -облаков в этом случае образовано одним электроном. Общее электронное облако таких пяти электронов имеет шарообразную форму, или, как говорят, сферически симметрично. По характеру распределения электронной плотности по разным направлениям оно похоже на 1 s -ЭО. Энергия подуровня, электроны которого образуют такое облако, оказывается меньше, чем в случае менее симметричного облака. В данном случае энергия орбиталей 3 d -подуровня равна энергии 4 s -орбитали. При нарушении симметрии, например, при появлении шестого электрона, энергия орбиталей 3 d -подуровня вновь становится больше, чем энергия 4 s -орбитали. Поэтому у атома марганца опять появляется второй электрон на 4 s -АО. Сферической симметрией обладает общее облако любого подуровня, заполненного электронами как наполовину, так и полностью. Уменьшение энергии в этих случаях носит общий характер и не зависит от того, наполовину или полностью заполнен электронами какой-либо подуровень. А раз так, то следующее нарушение мы должны искать у атома, в электронную оболочку которого последним "приходит"девятый d -электрон. И действительно, у атома меди на 3 d -подуровне 10 электронов, а на 4 s -подуровне только один. Уменьшение энергии орбиталей полностью или наполовину заполненного подуровня является причиной целого ряда важных химических явлений.
Задание №1. Способы выражения концентрации растворов.
Условия выполнения задания:
Задание №1. Ответить на поставленный вопрос.
Способы выражения концентрации растворов
1. Процентная концентрация – количество г вещества, находящихся в 100 г раствора.
5% р-ра С6Н12О6
100г р-ра – 5 г С6Н12О6, т. е.
5г С6Н12О6 +95г Н2О
Процентная концентрация связана массовыми единицами.
2. Молярная концентрация – количество молей, находящихся в 1 л раствора:
5м HCl NaСl=23+35,5=58,5
1 л – 58,5*5
3. Нормальная или эквивалентная концентрация – количество г эквивалентов, находящихся в 1 л раствора
Эквивалент кислоты = 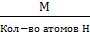 ;
;
Э(HCl) =  , Э(H2SO4)=
, Э(H2SO4)= 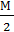 ,
,
Эквивалент основания = 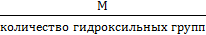 ;
;
Э(NaOH) =  , Э(Al(OH)3)=
, Э(Al(OH)3)=  ,
,
Эквивалент соли =  ;
;
Э(NaCl) =  , Э(Na2СО3) =
, Э(Na2СО3) =  ,
,
Э(Al 2(SO4)3) =  ;
;
Эквивалент оксида = 
2н Al 2(SO4) 3, эквивалент Al 2(SO4) 3= 
Например, в 1л раствора 2 
Задание №2. Приведите примеры следующих типов химических реакций: реакции разложения; реакции обмена
Задание №2. Реакции разложения:
AgNO3+NaCl=AgCl  +NaNO3
+NaNO3
CaCO3=CaO+CO2
Задание для экзаменующегося №23
Задание №1. Теория электролитической диссоциации.
Задание №2. Составить молекулярные, полные ионные и сокращенные ионные уравнения реакций следующих солей: а) хлорида хрома(III) и нитрата серебра; б) хлорида бария и сульфата марганца; в) нитрата железа (III) и гидроксида калия.
Задание №1. Ответить на поставленный вопрос.
Электролиты обладают различной способностью к диссоциации.
Степень диссоциации (a) -это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул электролита (n0):
a = n n0.
Степень диссоциации выражается или в десятичных дробях или, чаще, в процентах:
Если a = 1, или 100 %, электролит полностью диссоциирует на ионы.
Если a = 0,5, или 50 %, то из каждых 100 молекул данного электролита 50 находятся в состоянии диссоциации.
В зависимости от a различают:
Сильные электролиты, их a в 0,1 н. растворе выше 30 %.
Диссоциируют практически полностью.
Относятся:
– почти все соли;
– многие минеральные кислоты: H2SO4, HNO3, HCl, HClO4, HBr, HJ, HMnO4 и др.
– основания щелочных металлов и некоторых щелочноземельных металлов: Ba(OH)2 и Ca(OH)2.
Средние электролиты, их a от 3 до 30 %. К ним относятся кислоты H3PO4, H2SO3, HF и т.д.
Слабые электролиты в водных растворах диссоциированы лишь частично, их a менее 3 %.
Относятся:
– некоторые минеральные кислоты: H2CO3, H2S, H2SiO3, HCN;
– почти все органические кислоты;
– многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также гидроксид аммония;
– некоторые соли: HgCl2, Hg(CN)2.
Факторы, влияющие на a
Природа растворителя:
Чем больше диэлектрическая постоянная растворителя, тем больше степень диссоциации электролита в нем.
Концентрация раствора:
Степень диссоциации электролита увеличивается при разбавлении раствора.
При увеличении концентрации раствора уменьшается степень диссоциации (частое столкновение ионов).
Природа электролита:
Диссоциация электролита зависит от степени диссоциации.
Температура:
У сильных электролитов с повышением температуры a уменьшается, т.к. увеличивается число столкновений между ионами.
У слабых электролитов при повышении температуры a вначале повышается, а после 600 С начинает уменьшаться.
Константа электролитической диссоциации
В растворах слабых электролитов при диссоциации устанавливается динамическое равновесие между молекулами и ионами:
CH3COOH + H2O «CH3COO- + H3O+
[CH3COO-].[ H3O+] / [CH3COOH] =Кдисс
Задание №2. Составить молекулярные, полные ионные и сокращенные ионные уравнения реакций перечисленных солей.
а) CrCl3 + 3AgNO3 → Cr(NO3)3 + 3AgCl↓
Cr3+ + 3Cl- + 3Ag+ + 3NO3 → Cr3+ + 3NO3 + 3AgCl↓
Cl- + Ag+ → AgCl↓
б) BaCl2 + MnSO4 → BaSO4↓ + MnCl2
Ba2+ + 2Cl- + Mn2+ + SO42- → BaSO4↓ + Mn2+ + 2Cl-
Ba2+ + SO42- → BaSO4↓
в) Fe(NO3)3 + 3KOH → Fe(OH)3↓ + 3KNO3
Fe3+ + 3NO3- + 3K+ + 3OH- → Fe(OH)3↓ + 3K+ + 3NO3-
Fe3+ + 3OH- → Fe(OH)3↓
Задание №1. Гидролиз солей.
Задание №1. Ответить на поставленный вопрос.
Гидролиз солей - это обменная реакция соли с водой, в результате которой образуются слабые электролиты.
Вода, являясь слабым электролитом, диссоциирует на ионы Н+ и ОН-:
Н2О <-> ОН- + Н+
При растворении некоторых солей в воде ионы растворяемой соли взаимодействуют с ионами Н+ и ОН- воды.
Происходит смещение равновесия диссоциации воды:
один из ионов воды (или оба) связываются ионами растворенного вещества с образованием малодиссоциированного, или малорастворимого, продукта.
Каждую соль можно представить себе образованной основанием и кислотой.
Кислоты и основания – это сильные и слабые электролиты,
по этому признаку соли можно разделить на четыре типа:
соли, образованные катионом сильного основания и анионом сильной кислоты;
2) соли, образованные катионом сильного основания и анионом слабой кислоты;
3) соли, образованные катионом слабого основания и анионом сильной кислоты;
4) соли, образованные катионом слабого основания и анионом слабой кислоты.
Соли, образованные катионом сильного основании и анионом сильной кислоты гидролизу не подвергаются.
Такие соли полностью диссоциируют на ионы металла и кислотного остатка.
Например:
соль NaCl образована сильным основанием NaOH и сильной кислотой НСl и полностью диссоциирует на ионы.
Cоли, образованные катионом сильного основания и анионом слабой кислоты
Гидролиз этой соли заключается в присоединении ионами кислотного остатка ионов водорода от молекулы воды и в высвобождении ионов гидроокиси, которые обуславливают щелочную реакцию среды,
рН > 7
Na2S<-> 2Na+ + S2-
НОН <-> ОН- + Н+
HS-
S2- + НОН <-> HS- + ОН-
Na2 S + НОН = NaOH + NaHS
рН > 7
Соли, образованные катионом слабого основания и анионом сильной кислоты
Гидролиз этой соли заключается в присоединении ионами металла или ионами аммония ионов гидроокиси от молекулы воды и в высвобождении ионов водорода, которые обуславливают кислую реакцию среды,
рН < 7.
ZnCl2 <-> Zn2+ + 2Cl-
НОН =ОН- +Н+
ZnOH+
Zn2+ + НОН <-> ZnOH+ + Н+
ZnCl2 + НОН <-> НСl + ZnOHCl
рН < 7
Соли, образованные катионом слабого основания и анионом слабой кислоты
Гидролиз этой соли заключается в присоединении ионами металла или ионами аммония ионов гидроокиси, а ионами кислотного остатка ионов водорода от молекулы воды. Реакция среды будет нейтральная.
рН = 7
CH3COONH4 <-> CH3COO- + NH4+
НОН = Н+ + ОН-
СНзСООН NH4OH
СН3СОО + NH4+ + НОН <-> СНзСООН + NH4 OH
рН = 7
Задание №2. Дать характеристику положения элементов № 21, 32, 38 в Периодической системе Д.И. Менделеева. Написать их электронные формулы и структуры атомов.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 842; Нарушение авторских прав?; Мы поможем в написании вашей работы!