
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применение. При обычных условиях азот — газ без цвета, запаха и вкуса
|
|
|
|
Химические свойства
Физические свойства
При обычных условиях азот — газ без цвета, запаха и вкуса. Молекулярный азот при -195,8°С превращается в бесцветную жидкость. При дальнейшем охлаждении до -210,5°С появляются кристаллы твердого азота, похожие на снег или лед. Молекулярная масса 28, а воздуха 29 а.е.м. В воде растворим меньше, чем кислород: при 20°С в 1 л воды растворяется 15,4 мл азота (кислорода 31 мл). Поэтому в воздухе, растворенном в воде, содержание кислорода по отношению к азоту больше, чем в атмосфере. Малая растворимость объясняется весьма слабыми межмолекулярными взаимодействиями как между молекулами азота и воды, так и между молекулами азота.
Природный азот состоит из двух стабильных изотопов с массовыми числами 14 (99,64%) и 15 (0,36%).
1. При комнатной температуре N2 реагирует только с литием, а с кальцием при нагревании:
6Li+N2=2Li3N N2+3Ca=Ca3N2,
2. С другими металлами он реагирует только при высоких температурах, образуя нитриды:
N2+3Mg=Mg3N2 2Fe+N2=2FeN
Нитриды металлов имеют не вполне определенный состав. Некоторые из них представляют собой структуры внедрения, которые очень стойки, и поэтому обработку стали азотом применяют для упрочения поверхностного слоя металла. Некоторые нитриды металлов очень тверды, например, нитрид ванадия по твердости близок к алмазу.
3. Азот соединяется с кислородом при температуре электрической дуги (3000-4000°С):
2NO«N2+O2
4. При высоких температурах азот реагирует с другими неметаллами:
2В+N2=2BN
5. В присутствии катализатора, давления и при высокой температуре азот взаимодействует с водородом:
2NH3 С галогенами азот непосредственно не реагирует.«N2+3Н2
В больших количествах азот употребляется для получения аммиака. Широко используется для создания инертной среды — наполнения электрических ламп накаливания и свободного про-странства в ртутных термометрах, при перекачке горючих жидкостей. Им азотируют поверхность сталей.
Жидкий, а в случае необходимости и твердый азот применяют для глубокого охлаждения или вымораживания. Этим широко пользуются при химических, биологических и медицинских ис-следованиях, а также в криогенной технике.
9.Азотная кислота. Строение молекулы. Свойства и применение.
В лабораторных условиях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты:
NaNO3+H2SO4(к)=NaHSO4+HNO3 Реакция протекает при слабом нагревании.
Получение азотной кислоты в промышленных масштабах осуществляется каталитическим окислением аммиака кислородом воздуха:
1. Вначале смесь аммиака с воздухом пропускают над платиновым катализатором при 800°С. Аммиак окисляется до оксида азота (II):
4NH3 + 5O2=4NO+6Н2О
2. При охлаждении происходит дальнейшее окисление NO до NO2: 2NO+O2=2NO2
3. Образующийся оксид азота (IV) растворяется в воде в присутствии избытка О2 с образованием HNO3: 4NO2+2Н2O+O2=4HNO3
Исходные продукты — аммиак и воздух — тщательно очищают от вредных примесей, отравляющих катализатор (сероводород, пыль, масла и т.п.).
Образующаяся кислота является разбавленной (40-60% -ной). Концентрированную азотную кислоту (96-98% -ную) получают перегонкой разбавленной кислоты в смеси с концентрированной серной кислотой. При этом испаряется только азотная кислота.
Физические свойства
Азотная кислота — бесцветная жидкость, с едким запахом. Очень гигроскопична, «дымит» на воздухе, т.к. ее пары с влагой воздуха образуют капли тумана. Смешивается с водой в любых соотношениях. При -41,6°С переходит в кристаллическое состояние. Кипит при 82,6°С.
В HNO3 валентность азота равна 4, степень окисления +5. Структурную формулу азотной кислоты изображают так:

Оба атома кислорода, связанные только с азотом, равноценны: они находятся на одинаковом расстоянии от атома азота и несут каждый по половинному заряду электрона, т.е. четвертая часть азота разделена поровну между двумя атомами кислорода.
Электронную структуру азотной кислоты можно вывести так:
1. Атом водорода связывается с атомом кислорода ковалентной связью:

2. За счет неспаренного электрона атом кислорода образует ковалентную связь с атомом азота:
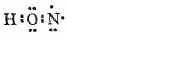
3. Два неспаренных электрона атома азота образуют ковалентную связь со вторым атомом кислорода:

4. Третий атом кислорода, возбуждаясь, образует свободную 2р-орбиталь путем спаривания электронов. Взаимодействие неподеленной пары азота со свободной орбиталью третьего атома кис-лорода приводит к образованию молекулы азотной кислоты:

|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 789; Нарушение авторских прав?; Мы поможем в написании вашей работы!